
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为:2H2+O2=2H2O
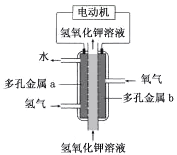
下列说法不正确的是
A. 多孔金属a作负极
B. 多孔金属b上,O2发生还原反应
C. 电池工作时,电解质溶液中OH- 移向a极
D. 正极的电极反应为:O2 +4e- +4H+ =2H2O
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
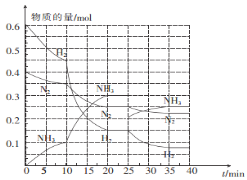
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均小于20。W、X、Y、Z的族序数之和为12;X与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是( )
A. ZWY是离子化合物,既可以与酸反应又可以与碱反应
B. 晶体X熔点高、硬度大,可用于制造光导纤维
C. 原子半径由小到大的顺序为:![]()
D. 热稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。

下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中美学者携手发现了全硼富勒烯团簇一B40,B40团簇的结构,酷似中国的红灯笼(如图)该材料可用于组装分子器件,在储氢储锂、半导体、超导、绿色催化等领域具有重要应用前景,下列有关说法正确的是
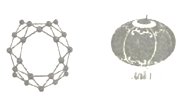
A.与石墨烯的结构相同,二者互为同素异形体
B.44.0g该物质含有2.408×1024个原子
C.B40中既含极性键,又含有非极性键
D.全硼富勒烯团簇是一种新型的高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C.200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:
4Fe2+ + 6Br-+ 5Cl2 == 4Fe3+ + 3Br2 + 10Cl-
D.Na2S的水解:S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol/L,FeCl2 3.0 mol/L,FeCl3 1.0 mol/L,HCl 3.0 mol/L。取废腐蚀液200 mL按如下流程在实验室进行实验:
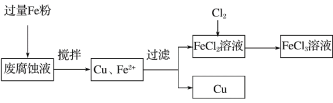
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是________(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为__________________________________。
(3)如图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。

实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是__________________________________。
(4)按上述流程操作,需称取Fe粉的质量应不少于________ g(精确到0.1 g),需通入Cl2的体积不少于________ L(标况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com