
分析 (1)①H2SO4溶液是强酸溶液;②NaHCO3溶液是强碱弱酸盐溶液;③NH4Cl溶液是强酸弱碱盐溶液;④NaOH溶液是强碱溶液;
(2)NH4Cl溶液是强酸弱碱盐溶液,水解显酸性,根据电荷守恒来分析;
(3)③NH4Cl溶液水解显弱酸性,④NaOH溶液显强碱性,故③的酸性远弱于等浓度的④的碱性;
(4)常温下,将②和④等体积混合后两者反应生成Na2CO3溶液,是强碱弱酸盐,水解显碱性.
解答 解:(1)①H2SO4溶液是强酸溶液;②NaHCO3溶液是强碱弱酸盐溶液;③NH4Cl溶液是强酸弱碱盐溶液;④NaOH溶液是强碱溶液;由于盐类的水解程度很小,故等浓度的四种溶液的pH由大到小的排列顺序是④②③①,故答案为:④②③①;
(2)NH4Cl溶液是强酸弱碱盐溶液,水解显酸性,故有:c(H+)>c(OH-);而根据电荷守恒可知:c(H+)+c(NH4+)=c(OH-)+c(Cl-),则有:c(Cl-)>
c(NH4+),故有:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)③NH4Cl是强碱弱碱盐,水解显弱酸性,由于盐类的水解程度很小,故氯化铵溶液的酸性很弱;而④NaOH是可溶性强碱,故③的酸性远弱于等浓度的④的碱性,则若将③和④混合后溶液恰好呈中性,则混合前③的体积大于④的体积,故答案为:大于;
(4)常温下,将②和④等体积混合后两者反应生成Na2CO3溶液,是强碱弱酸盐,水解显碱性,水解方程式为:CO32-+H2O?HCO3-+OH-,故向混合后的溶液中加入酚酞,溶液变红,故答案为:CO32-+H2O?HCO3-+OH-.
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | KOH和Al2(SO4)3 | B. | NaOH和Ca(HCO3)2 | C. | NaAlO2和 HCl | D. | K2CO3和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①表示2molC(s)燃烧生成2molCO(g)需要吸收221 kJ的热量 | |
| B. | 碳的燃烧热大于110.5 kJ/mol | |
| C. | 稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
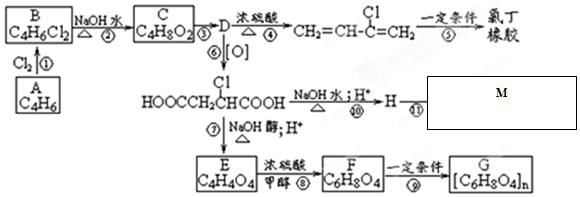

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.3℃ | -56.8kJ/mol |
| ② | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
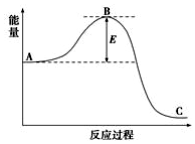 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH | B. | -COOH | C. | -C 6H 5 | D. | -NH 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
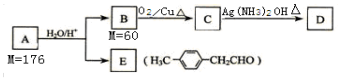
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com