
下列说法不正确的是
A. 用小苏打(NaHCO3)发酵面团制作馒头
B. 光导纤维的主要成分是SiO2
C. 干燥的氯气和液氯均能使干燥的有色布条褪色
D. 用Al(OH)3治疗胃酸过多
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源:2017届陕西省宝鸡市高三教学质量检测(一)理综化学试卷(解析版) 题型:选择题
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
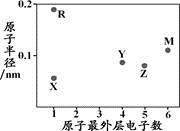
A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:实验题
为验证浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,设计如下实验:
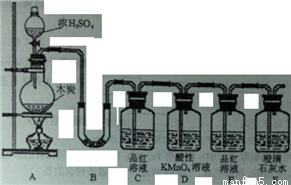
(1)写出浓硫酸与木炭粉反应的化学方程式_____________。
(2)B中加入的试剂是_____,现象是______;C的作用是____,E的作用是________。
(3)如果将F放在B、C之间,则一定不能检出的物质是_______。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
A. Br-、Fe2+、I- B. I-、Fe2+、Br-
C. Br-、I-、Fe2+ D. Fe2+、I-、Br-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 在水溶液中:H+、I-、NO3-、SiO32-
B. 饱和氯水中:Cl-、NO3-、Na+、SO3-
C. 将足量CO2通入时:H+、NH4+、Al3+、SO42-
D. 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:计算题
镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀生成,同时有氨气逸出,且逸出的氨气干燥后全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:
(1)根据上述信息写出Mg和硝酸反应的化学方程式:____________________。
(2)发生还原反应的硝酸的物质的量为________mol。
(3)参加反应的镁的质量为_________g。
(4)原稀硝酸的物质的量浓度为_________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是
①AgNO3溶液 ②NaOH溶液 ③水
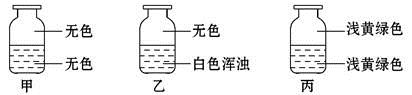
A. ①②③ B. ②①③ C. ③②① D. ①③②
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:简答题
化学在解决雾霾污染中有着重要的作用,雾霾由多种污染物形成,其中包含颗粒物PM2.5)、
氮氧化物(NOx)、CO、SO2等.
(1)已知:NO(g)+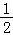 O2(g)═NO2(g)△H=﹣56.5kJ•mol﹣1
O2(g)═NO2(g)△H=﹣56.5kJ•mol﹣1
2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJ•mol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)△H=_________kJ•mol﹣1.
一定条件下,将NO2与SO2以物质的量比1:2置于恒温恒容的密闭容器中发生上述反应,
下列能说明反应达到平衡状态的有____________
a.混合气体的平均相对分子质量
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2物质的量比为1:3,则平衡常数K=________(用分数表示)
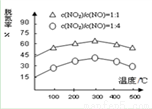
NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO),不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请解释300℃之后脱氮率逐渐减小的原因:__________________________
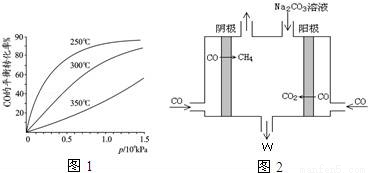
(2)CO综合利用.
①CO用于合成甲醇反应方程式为:CO(g)+2H2(g)═CH3OH(g)
若起始投入1molCO,2mol H2,CO在不同温度下的平衡转化率与压强的关系如图所示.得知该反应的△H_________0,该反应的实际生产条件控制在 250 ℃、1.3×104kPa左右最为适宜.反应达平衡后,下列操作既能加快反应速率,又能使平衡混合物中CH3OH物质的量分数增大的是____________
a. 升温 b.恒容条件下充入H2
c.加入合适的正催化剂 d.恒容条件下再充入1molCO,2mol H2
e.压缩体积 f.移走一部分CH3OH
②电解CO制备CH4,电解质为碳酸钠溶液,工作原理如图2所示,写出阴极区电极
反应式_______________
(3)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l)  H2SO3(l)
H2SO3(l)  H+(aq)+HSO
H+(aq)+HSO (aq) Ⅰ
(aq) Ⅰ
HSO (aq)
(aq)  H+(aq)+SO
H+(aq)+SO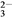 (aq) Ⅱ
(aq) Ⅱ
Ca(OH)2(s)  Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+2OH-(aq) Ⅲ
Ca2+(aq)+SO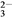 (aq)
(aq)  CaSO3(s) Ⅳ
CaSO3(s) Ⅳ
该温度下,测定吸收后液体中c(Ca2+)一直保持为0.70 mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO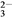 的浓度为_________________
的浓度为_________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:简答题
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)Δ H1=+489.0 kJ·mol-1
C(s,石墨)+CO2(g)=2CO(g) ΔH 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为________________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的
ΔH____________0(填“>”、“<”或“=”,下同)。
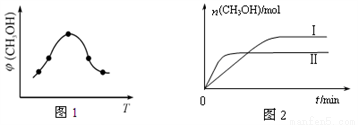
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ____________KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成。开始以氨碳比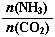 =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_______________。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_______________。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,则NH4HCO3溶液呈_______________(填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com