
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子的核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第________周期第________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的基态原子的核外电子排布式是________,Y的第一电离能比X的________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是__________________________________________________________________
________________________________________________________________________。
解析 首先注意题目信息中的“前36号”“常见元素”“原子序数依次增大”。W、Y的氧化物是导致酸雨的主要物质,应该是NO2和SO2,再依据“原子序数依次增大”的信息,可知W为N元素,Y为S元素。X的基态原子核外有7个原子轨道填充了电子,其核外电子排布式应为1s22s22p63s23p1。该元素应为Al。Z能形成红色(或砖红色)Z2O和黑色的ZO两种氧化物,可知Z为Cu。
(1)W(N)位于元素周期表第二周期第VA族。W的气态氢化物为NH3,因N的非金属性比O弱,故NH3稳定性比H2O弱。(2)Y的基态原子的核外电子排布式是1s22s22p63s23p4;Y(S)的原子半径小于X(Al),所以Y(S)的原子核对外层电子的吸引力强于X(Al)的原子核,故Y的第一电离能比X的大。(3)Y的最高价氧化物对应水化物为H2SO4,其浓溶液(即浓硫酸)与Z的单质(Cu)反应的化学方程式是:Cu+2H2SO4(浓)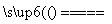 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
答案 (1)二 ⅤA 弱
(2)1s22s22p63s23p4 大
(3)Cu+2H2SO4(浓)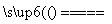 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于铁的叙述正确的是 ( )。
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含有铁元素 ③铁位于元素周期表中第四周期第ⅧB族 ④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 ⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3 ⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④
C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现有室温下四种溶液,有关叙述不正确的是( )
| 序号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH ①>②>④>③
D.V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1< V2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( )
A.加入少量水,产生H2速率减小,H2体积不变
B.加入NH4HSO4固体,产生H2速率不变,H2体积不变
C.加入CH3COONa固体,产生H2速率减小,H2体积不变
D.滴加少量CuSO4溶液,产生H2速率变大,H2体积不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的X和Y两种原子,化学性质一定相似的是 ( )。
A.X原子和Y原子最外层都只有1个电子
B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C.X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D.X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验或实验装置进行的实验中,能达到相应实验目的的是( )
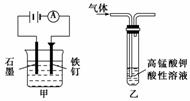
A.装置甲:防止铁钉生锈
B.测定同温同浓度的NaCl和NaF溶液的pH,确定F、Cl两元素的非金属性的强弱
C.装置乙:除去乙烷中混有的乙烯
D.用Ca(OH)2溶液来鉴别Na2CO3溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe、Cu都是人类最早使用的金属。某校化学研究性学习小组的同学运用实验手段研究Fe、Cu的相关性质,请你参与研究并完成下列各题:
(1)甲同学取一束细铜丝用砂纸打磨后放在酒精灯上加热至红热,然后迅速伸入盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是__________________________________________________________________________________________________________________________________________。
(2)乙同学为探究Fe在冷浓硝酸和热浓硝酸中的反应情况,设计了如图所示的实验装置:
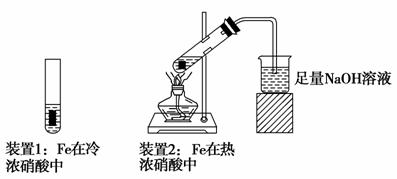
①乙同学发现装置1中Fe未溶解,其原因是________________________________________________________________________;
②装置2生成的气体(假定为NO2和NO混合气体)全部通入100 mL 4 mol·L-1 NaOH溶液,恰好被完全吸收,反应为:NO+NO2+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
若生成NaNO3和NaNO2物质的量之比为1∶3,则混合气体中NO2和NO的体积比为________。
(3)丙同学在Fe和浓硝酸反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应。他依据的反应现象是_______________________________________________
________________________________________________________________________。
②丁同学认为丙同学的结论不完全正确,他的理由是
________________________________________________________________________。
(4)请你设计实验证明(3)反应后的溶液中只含Fe2+而不含Fe3+。说明具体实验操作和实验现象:________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由C、H、O三种元素组成的某有机化合物8.8 g,完全燃烧后生成CO2和H2O的质量分别是22.0 g和10.8 g,则该化合物的分子式为( )
A.C5H6O B.C5H12O
C.C5H12O2 D.C5H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO ===2X2++5Z2+8H2O
===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此判断下列说法正确的是( )
A.反应Z2+2A2+===2A3++2Z-不能进行
B.Z元素在①③反应中均被氧化
C.氧化性由弱到强的顺序是XO 、Z2、B2、A3+
、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com