
分析 (1)Fe3+遇到KSCN溶液呈红色;
(2)Cu2O遇到酸产生Cu,Cu能与Fe3+反应;
(3)若固体全部溶解,则一定存在Fe2O3和Cu2O,根据物质的相关性质书写反应的有关离子方程式
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
解答 解:(1)若假设1成立,则溶液中含有Fe3+,遇到KSCN溶液呈红色,故答案为:固体完全溶解,溶液呈血红色;
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu能与Fe3+反应:2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确,
故答案为:不合理;当原粉末为Fe2O3和Cu2O的混合物时,加入稀硫酸后产生的Fe3+全部与Cu反应生成Fe2+,滴加KSCN溶液后也不变红色;
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,涉及反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3和Cu2O;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO△m
288g 32g
m (b-a)g
m=$\frac{288×(b-a)g}{32g}$=9(b-a)g,混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$,
故答案为:$\frac{9(b-a)}{a}×100%$.
点评 本题考查实验的设计及评价,以及物质的组成的测定,并涉及运用差量法进行计算,本题难度较大,做题时注意把握题给信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
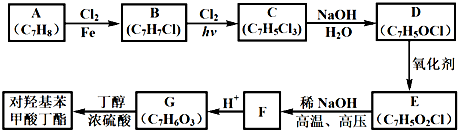
 .
. (写一种结构简式)
(写一种结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
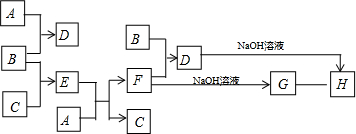
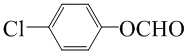
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴离子符号 | 物质的量浓度(mol•L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、D两种元素形成的化合物中只含有极性键 | |
| B. | A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 | |
| C. | 原子半径由大到小的顺序是F>E>C>D | |
| D. | 最高价氧化物对应水化物酸性最强的元素是C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑨ | B. | ①③⑨ | C. | ③⑨⑩ | D. | ③⑦⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com