
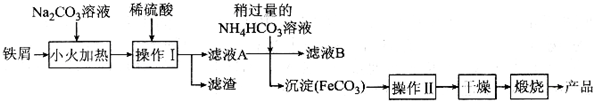
分析 (1)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子;
(2)用碳酸钠溶液除去Fe表面的油污,加稀硫酸除去碳酸钠,且溶解Fe,过除去不溶物滤,滤液A中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,再过滤分离,碳酸亚铁经过洗涤、干燥、煅烧得到氧化铁;
(3)①亚铁离子具有还原性,不能用氧化性酸酸化,酸性高锰酸钾溶液具有强氧化性,不能用盐酸酸化;
②由Fe元素守恒、电子转移守恒可得关系式:5FeO~5Fe2+~KMnO4,结合关系式计算样品中FeO的质量,进而计算氧化铁的质量分数.
解答 解:(1)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)用碳酸钠溶液除去Fe表面的油污,加稀硫酸除去碳酸钠,且溶解Fe,过除去不溶物滤,滤液A中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,再过滤分离,碳酸亚铁经过洗涤、干燥、煅烧得到氧化铁.
①操作Ⅰ是分离互不相溶的固体与液态,应是过滤,操作Ⅱ为洗涤,洗涤操作的具体方法为:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次,
故答案为:过滤;沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;
②滤液A中含有FeSO4等,加入稍过量的NH4HCO3溶液生成碳酸亚铁沉淀,同时有一种气体产生,该气体为二氧化碳,反应化学方程式:FeSO4+2NH4 HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:FeSO4+2NH4 HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(3)①亚铁离子具有还原性,硝酸具有强氧化性,不能用硝酸酸化,酸性高锰酸钾溶液具有强氧化性,不能用盐酸酸化,
故选:c;
②由Fe元素守恒、电子转移守恒可得关系式:5FeO~5Fe2+~KMnO4,
设样品中FeO的质量为m,则:
5FeO~5Fe2+~KMnO4
360g 1mol
m×$\frac{25mL}{250mL}$ 0.02L×0.01mol/L
所以 360g:m×$\frac{25mL}{250mL}$=1mol:0.02L×0.01mol/L
解得m=0.72g
则样品中氧化铁的质量分数为$\frac{3g-0.72g}{3g}$×100%=76%,
故答案为:76%.
点评 本题考查物质制备实验、定量测定实验、氧化还原反应、混合物分离提纯、实验基本操作等,需要学生熟练掌握元素化合物知识,明确工艺流程原理,为高考常考题型,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Na+、Ca2+、SO42-、CO32- | |
| B. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| C. | 氯水溶液:H+、Fe2+、SO42-、Cl- | |
| D. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C |
| D |
| A. | C的非金属性最强,可与E元素形成共价化合物 | |
| B. | 元素D可形成三种价态的酸,且酸根离子均能促进水的电离 | |
| C. | 原子半径由大到小的排列顺序为:E>D>B>A>C | |
| D. | C、D元素形成的最简单的氢化物的热稳定性:D<C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
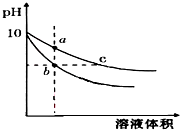 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH 随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )| A. | b、c两点溶液的导电能力不相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc | |
| D. | c点溶液中C(H+)+C(CH3COOH)=C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的干馏是煤气化的重要方法,也是煤综合利用最“古老”的、最简单的方法.某实验小组根据教材习题设计了煤干馏实验,装置如图所示.实验时,取约2-3g的煤粒,在研体中研磨至粉末状态;用药匙将煤粉放入试管中,在具支试管中加入2mL水,按照如图所示安装好装置;点燃酒精灯,对试管预热后再集中受热,待具支试管中气泡产生的速度均匀后,在具支试管口收集气体,并用明火靠近具支试管口,可以观察到产生的气体能够燃烧.根据上述实验回答下列问题:
煤的干馏是煤气化的重要方法,也是煤综合利用最“古老”的、最简单的方法.某实验小组根据教材习题设计了煤干馏实验,装置如图所示.实验时,取约2-3g的煤粒,在研体中研磨至粉末状态;用药匙将煤粉放入试管中,在具支试管中加入2mL水,按照如图所示安装好装置;点燃酒精灯,对试管预热后再集中受热,待具支试管中气泡产生的速度均匀后,在具支试管口收集气体,并用明火靠近具支试管口,可以观察到产生的气体能够燃烧.根据上述实验回答下列问题: +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O;
+H2O;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
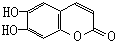 )具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )
)具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚类化合物又可看成酯类化合物 | |
| C. | 能与银氨溶液发生银镜反应 | |
| D. | 1 mol该物质最多与3 mol Br2 发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电化学应用 | 相关解释或说法 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极产生H2,正极处吸收O2 |
| D | 将铜闸门与外加电源负极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com