
一定条件下存在反应:H2(g) + I2(g) 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
C
【解析】
试题分析:A.容器Ⅰ从正反应方向开始,开始时正反应速率最大,容器Ⅱ从逆反应方向开始,开始时正反应速率最小,是0.因此开始时正反应速率不相同,错误;B.增大压强平衡不发生移动,但是由于反应是在恒容绝热的环境中进行,当反应达到平衡时容器Ⅰ、Ⅲ中温度不等,二者的反应的平衡常数就不相同,错误;C.该反应的正反应是放热反应,随着反应的进行,反应容器的温度升高,由于升高温度,平衡向吸热的逆反应方向移动,而容器Ⅱ是从逆反应方向开始,随着反应的进行,容器内的温度逐渐降低,根据平衡移动原理:降低温度,平衡向放热的正反应方向移动,因此容器Ⅰ中的I2气体的物质的量比容器Ⅱ高,所以混合气体的颜色比容器Ⅱ中的气体颜色深,正确;D.在温度不变时反应从正反应方向开始与从逆反应方向开始,物质的转化率的和为1,由于反应恒容绝热,所以容器Ⅰ中H2的转化率比恒温时小,容器Ⅱ中HI的转化率也比恒温是小,因此二者之和小于1,错误。
考点:考查恒容绝热条件下,从正逆相反方向开始的反应的物质的转化率、平衡含量的计算的知识。


科目:高中化学 来源:2014-2015学年湖南省益阳市高一12月月考化学试卷(解析版) 题型:选择题
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的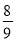 (同温同压下),此时N2、O2、CO2的物质的量之比为
(同温同压下),此时N2、O2、CO2的物质的量之比为
A.1∶1∶0 B.6∶9∶0 C.3∶4∶1 D.3∶3∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:填空题
(18分)依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池,如图所示。
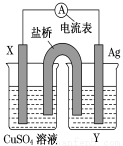
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________溶液。(填名称)
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为____________________________。
(3)外电路中的电子是从________极流向______极(填电极材料)。外电路中每通过0.1 mol电子,银电极的质量理论上增加 g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向 电极。
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次质量检测化学试卷(解析版) 题型:选择题
将等质量的两份锌粉a、b分别加入过量的稀硫酸。同时向a中加入少量CuSO4溶液。图中产生H2的体积V L与时间t min的关系正确的是
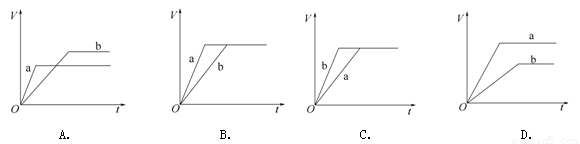
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考理综化学试卷(解析版) 题型:填空题
(14分)碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
2Fe(s) + 3CO(g) +6H2(g) ⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是

①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO )>c(OH
)>c(OH )> c(H+)
)> c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邢台市高三上学期第四次月考化学试卷(解析版) 题型:实验题
(10分).苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
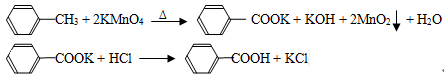
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
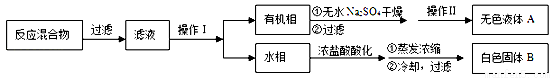
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶 解, | 得到白色晶体和无色溶液 | ----------------- |
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
③ | 干燥白色晶体, | 熔点为122.4℃ | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数为 (保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邢台市高三上学期第四次月考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。下列推断错误的是
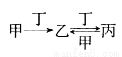
A.若丙为CO2,则甲可以是焦炭
B.若丁为O2,则甲可以是N2
C.若丁为Fe,则甲可以是Cl2
D.若丁为CO2,则甲可以是NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
(13分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
(4)实验步骤:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 、
。
(5)数据处理:试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
。
(6)实验优化:从环境保护的角度,请你提出一个优化方案将此实验装置进一步完善:
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高三上学期期中考试化学试卷(解析版) 题型:选择题
对某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色无味的气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH
D.向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com