
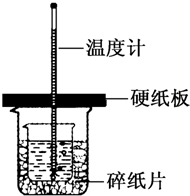
 根据中和热的测定实验填空.
根据中和热的测定实验填空.| Q |
| n |
| 100g×4.18J/(g?℃)?(t-18℃) |
| 0.025mol |
| 0.418(t-18℃) |
| 0.025 |
| 0.418(t-18℃) |
| 0.025 |


科目:高中化学 来源: 题型:
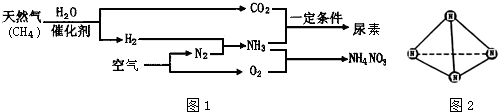
查看答案和解析>>
科目:高中化学 来源: 题型:
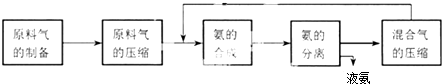
| A、混合气进行循环利用遵循绿色化学思想 |
| B、对原料气进行压缩可以增大原料气的转化率 |
| C、合成氨反应须在低温下进行 |
| D、使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g |
| B、(2m-3.2)g |
| C、(m-1.6)g |
| D、(2m-1.6)g |
查看答案和解析>>
科目:高中化学 来源: 题型:
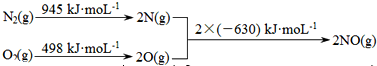
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu元素和O元素的物质的量之比为4:1 |
| B、硝酸的物质的量浓度为2.6 mol/L |
| C、产生的NO在标准状况下的体积为4.48L |
| D、Cu、Cu2O和CuO与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无论a、b大小关系如何,再加入气体A时,平衡一定向正反应方向移动 |
| B、若a<b,再加入A并达到平衡时,A的体积分数较原平衡更大 |
| C、若a>b,再加入A时,A的转化率增大 |
| D、加入气体A后,当反应再次达到平衡时,反应速率与原平衡时的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
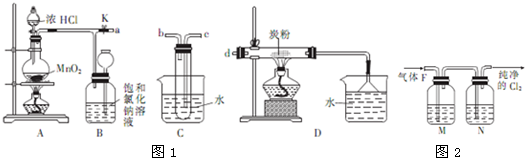
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com