
| A. | Q1=Q | B. | Q1<Q | C. | 2Q1<Q | D. | 无法判断 |
分析 根据可逆反应的特点可知,可逆反应是不能进行到底的反应,即反应后的体系中含有所有反应物和生成物,反应热与化学计量数成正比.
解答 解:若将 1mol SO2和0.5mol O2在相同条件下放入密闭容器发生反应,因2SO2+O2?2SO3是可逆反应,则 1molSO2和0.5mol O2不会完全反应生成1molSO3,即生成SO3的量小于1mol,根据反应2SO2+O2?2SO3,当生成2molSO3时放出热量为Q,生成1molSO3放出的热量为$\frac{1}{2}$Q,则生成小于1mol的 SO3 时放出的热量必小于$\frac{1}{2}$Q,即 Q1<$\frac{1}{2}$Q,2Q1<Q,
故选C.
点评 本题考查可逆反应与反应热间的关系,掌握可逆反应的特点是解答该题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu和稀硝酸反应制Cu(NO3)2 | |
| B. | Cu和浓硝酸反应制Cu(NO3)2 | |
| C. | 铜在空气中受热转化为CuO,再溶于稀硝酸制Cu(NO3)2 | |
| D. | 铜在氧气中受热转化为CuO,再溶于浓硝酸制Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | (NH4)2CO3 | C. | NaCl | D. | K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
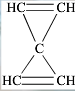 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ]-.
]-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com