
【题目】CO2和CH4是两种温室气体,研究它们具有重要的意义。
(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1。则![]()
![]() △H=_________kJ·mol-1
△H=_________kJ·mol-1
(2)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示为: ![]()
![]() △H=-86.98 kJ·mol-1
△H=-86.98 kJ·mol-1
反应中影响CO2平衡转化率的因素很多,右图为某特定条件下,不同水碳比[n(H2O/n(CO2)]和温度对CO2平衡转化率的影响曲线。

①为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有___________________、____________________。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是_______________。
(3)向1.0 L密闭容器中通入0.2 mol NH3(g)和0.1 mol CO2(g),在一定温度下发生反应则![]()
![]() ,反应时间与气体总压强(p)的数据如下表:
,反应时间与气体总压强(p)的数据如下表:
![]() 用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
用起始压强和总压强计算平衡时NH3的转化率为_________,0~80 min内CO2的平均反应速率是__________。
(4)氨基甲酸铵(NH2COONH4)极易水解成碳酸铵,在酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入到1 L 0.1 mol·L-1的盐酸中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,溶液中几乎不含碳元素。此时溶液中c(NH4+)=__________,NH4+水解平衡常数为__________。
【答案】 247.3kJ·mol-1 增大压强 降低碳水比(或增大氨气浓度) 正反应是放热反应,温度高于190℃,升温平衡向逆方向进行,二氧化碳的平衡转化率降低。 80% 0.001 mol·L-1·min-1 0.1 mol·L-1 4×10-9 mol·L-1
【解析】(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1,则①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ· mol-1,②H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ· mol-1,③CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ· mol-1,根据盖斯定律①-(②+③)×2即可得到![]()
![]() △H=+247.3kJ·mol-1;(2)①正反应是体积减小的放热反应,所以为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有增大压强、降低碳水比(或增大氨气浓度)。②由于正反应是放热反应,温度高于190℃,升温平衡向逆方向进行,因此二氧化碳的平衡转化率降低。(3)气体压强之比等于气体物质的量之比,设氨气消耗物质的量xmol,则
△H=+247.3kJ·mol-1;(2)①正反应是体积减小的放热反应,所以为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有增大压强、降低碳水比(或增大氨气浓度)。②由于正反应是放热反应,温度高于190℃,升温平衡向逆方向进行,因此二氧化碳的平衡转化率降低。(3)气体压强之比等于气体物质的量之比,设氨气消耗物质的量xmol,则
2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)
起始量在(mol) 0.2 0.1 0 0
变化量(mol) x 0.5x 0.5x 0.5x
平衡量(mol) 0.2-x 0.1-0.5x 0.5x 0.5x
气体压强之比等于气体物质的量之比,图表中可知80min反应达到平衡状态,(0.2+0.1)/(0.2x+0.10.5x+0.5x)=9.53/4.45,解得x=0.16mol,平衡时NH3 的转化率=0.16mol/0.2mol×100%=80%。0~80min内CO2的反应速率v=△c/△t=0.5×0.16mol/(1L×80min)=0.001mol/(Lmin);(4)因为氨基甲酸铵极易水解成碳酸铵,即反应式为NH2COONH4(s)+H2O(NH4)2CO3,加入1L0.1mol/L的盐酸溶液中直到溶液pH=7并且溶液中几乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根据电荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸铵,所以开始溶液中的铵根离子浓度为0.052mol/L×2=0.104mol/L,则
NH4++H2ONH3H2O+H+
开始 0.104mol/L 0
转化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液为pH=7,所以氢离子浓度为10-7mol/L,则NH4+水解平衡常数K=c(NH3H2O)c(H+)/c(NH4+)=0.004×107/0.1=4×10-9。


科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置 如右下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法不正确的是

A. a极与电源的正极相连
B. 产物丙为硫酸溶液
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. a电极反应式为2H2O+2e-=2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物有的是药物,有的是香料。它们的结构简式如下所示:
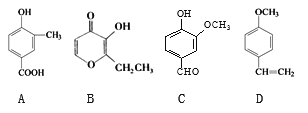
(1)化合物A的分子式是__________;D中含氧官能团的名称是____________;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号)_____________;
(3)化合物B的核磁共振氢谱中出现________组峰;
(4)1mol C最多能与________mol的氢气发生加成反应;
(5)C的苯环上的一氯取代物有_________种。
(6)写出D形成的高分子化合物的结构简式:______________。
(7)写出2,3-二甲基-2-丁烯的键线式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的分子式为C4H4O3 ,根据图示填空。

(1)化合物A中含有的官能团是________(填名称)。
(2)1 mol A与2 mol H2反应生成1 mol E,写出该反应的方程式_______________________ ,该反应的反应类型为_________,
(3)与A具有相同官能团的A的同分异构体的结构简式是_______。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是______________。
(5)F的结构简式是________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,则钒原子的价电子排布式正确的是( )
A. 3s23p6B. 3d34s2C. 3d64s2D. 4s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和冶疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以2-氯苯甲醛为原料合成该药物的路线如下:

(1)A分子中“共面的原子数目最多为________个。
(2)C含有多种官能团,能发生缩聚反应。请写出C在一定条件下聚合成高分子化合物的化学方程式____________________。
(3)由E转化为氯吡格雷时,相伴生成的另一种产物的名称为________。
(4)物质G是物质A的同系物,比A多一个碳原子,且能发生银镜反应,除苯环之外无其他环状结构;则符合上述条件的G的同分异构体共有______种。其中核磁共振氢谱中有4个吸收峰,且峰值比为2:2:2:1的结构简式为___________(任写一种)。
(5)已知: ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图___________(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图___________(无机试剂任选)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:

(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为____________ ,此过程中发生的氧化还原反应为(用化学方程式表达)_________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com