
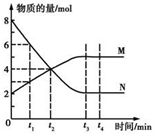
| A. | 反应的化学方程式为2 M?N | |
| B. | t2 min时,正逆反应速率相等,反应达到平衡 | |
| C. | t3 min后,正逆反应仍在进行 | |
| D. | t3~t4 min时,v正(N)=v逆(M) |
分析 由图可知,N的物质的量减少,M的物质的量增加,则N为反应物、M为生成物,且△n之比为(8-4):(4-2)=2:1,t3min达到平衡状态,可知反应为2N?M,以此来解答.
解答 解:A.N为反应物、M为生成物,且△n之比为(8-4):(4-2)=2:1,t3min达到平衡状态,可知反应为2N?M,故A错误;
B.t2 min时,N的物质的量仍在减少,则正反应速率大于逆反应速率,故B错误;
C.t3 min后,为平衡状态,为动态平衡,则正逆反应仍在进行,故C正确;
D.t3~t4 min时,为平衡状态,则v正(N)=2v逆(M),故D错误;
故选C.
点评 本题考查物质的量随时间的变化图象,为高频考点,把握图中物质的量变化、平衡状态判断为解答的关键,侧重分析与应用能力的考查,注意平衡时不同物质的正逆反应速率之比等于化学计量数之比,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;BA4的结构式
;BA4的结构式 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
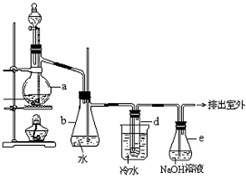 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-离子的结构示意图: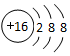 | B. | 硫酸铝的化学式:AlSO4 | ||
| C. | H2O2中O的化合价为-2价 | D. | 钾原子的原子结构示意图: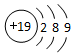 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为78 | B. | 质子数为53 | C. | 核外电子数为131 | D. | 中子数为53 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com