
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
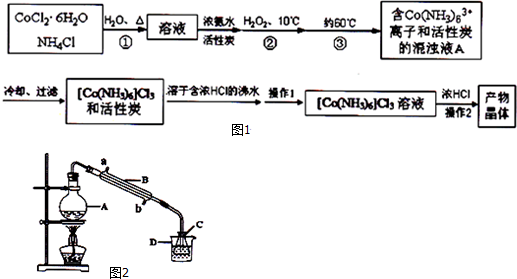
分析 三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O,煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体溶解,得到溶液加入浓氨水和活性炭,加入10°C的过氧化氢,需要水浴加热保持温度60°C反应得到含[Co(NH3)6]3+离子和活性炭的浑浊液A,冷却过滤得到[Co(NH3)6]Cl3和活性炭,溶于含浓盐酸的沸水中趁热过滤,得到的[Co(NH3)6]Cl3 溶液中加入浓HCl,过滤得到晶体,浓盐酸有利于[Co(NH3)6]Cl3析出,提高产率,
(1)加热煮沸和研细加快固体溶解;
(2)过氧化氢是氧化剂,能氧化+2价钴离子为+3价,温度低于100°C的反应条件需要水浴加热;
(3)过滤是滤纸先用蒸馏水湿润,用玻璃棒压实;
(4)为减少溶液中溶质析出,实验操作1是趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度利于晶体析出;
(5)①装置图中仪器图象可知仪器为圆底烧瓶;
②[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl,结合化学方程式定量关系计算需要氢氧化钠溶液的体积;
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠量减少,测定氨气量增多.
解答 解:(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体的溶解,故答案为:加速固体溶解;
(2)依据流程可知向CoCl2•6H2O加入过氧化氢后得到Co(NH3)63+,加入过氧化氢是氧化剂能把+2价钴离子为+3价,第③步中保持60℃的加热方法是水浴加热,
故答案为:做氧化剂;水浴加热;
(3)结合过滤的基本操作,过滤时滤纸先用蒸馏水润湿,然后用玻璃棒压实滤纸,排出滤纸和漏斗之间的气泡,
故答案为:玻璃棒;
(4)流程图提供的信息可知,实验操作Ⅰ为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度,依据沉淀溶解平衡理论,平衡想析出晶体的方向移动,所以加入浓盐酸的目的是有利于[Co(NH3)6]Cl3析出,提高产率,
故答案为:有利于[Co(NH3)6]Cl3析出,提高产率;
(5)①仪器特征和图形可知仪器A名称为圆底烧瓶,故答案为:圆底烧瓶;
②0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),物质的量=$\frac{0.2675g}{267.5g/mol}$=0.001mol,滴定过程分析可知发生的反应依次为[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl,NH3+HCl=NH4Cl,HCl+NaOH=NaCl+H2O,放出氨气物质的量总计为0.006mol,消耗HCl物质的量0.006mol,HCl总物质的量=0.0250L×0.5mol/L=0.0125mol,所以消耗剩余HCl需要氢氧化钠物质的量=0.0125mol-0.006mol=0.0065mol,当滴定到终点时,共消耗NaOH溶液的体积=$\frac{0.0065mol}{0.5mol/L}$=0.0013L=13.00ml,
故答案为:13.00;
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠的量减少,测定氨气量增多,x值将偏大,故答案为:偏大.
点评 本题考查了物质制备、物质性质、物质组成、滴定实验的过程分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2- | |
| C. | FeCl3溶液:K+、Na+、Fe2+、S2- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
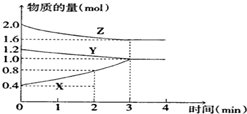 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 25℃时 | pH[] |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com