
【题目】下列叙述正确的是
A.常温下,将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.常温下,![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中![]() 的值增大
的值增大
【答案】C
【解析】
A.将稀氨水逐滴加入稀硫酸中,当溶液![]() 时,溶液中氢离子浓度等于氢氧根离子浓度;溶液呈电中性,所以阴阳离子所带电量相等,所以
时,溶液中氢离子浓度等于氢氧根离子浓度;溶液呈电中性,所以阴阳离子所带电量相等,所以![]() ,故A错误;
,故A错误;
B.醋酸是弱电解质,在水溶液中只有部分电离,所以醋酸的浓度大于氢离子浓度;两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() 的两种醋酸溶液中氢离子浓度之比
的两种醋酸溶液中氢离子浓度之比![]() :1,当两种酸的电离度相同时,则
:1,当两种酸的电离度相同时,则![]() ,实际上,两种酸的浓度不等,且浓度越大,酸的电离度越小,所以两种酸的浓度关系为
,实际上,两种酸的浓度不等,且浓度越大,酸的电离度越小,所以两种酸的浓度关系为![]() ,故B错误;
,故B错误;
C.![]() 的NaOH溶液的
的NaOH溶液的![]() ,
,![]() 醋酸溶液的
醋酸溶液的![]() ,等体积的两种溶液
,等体积的两种溶液![]() ,醋酸有剩余,但
,醋酸有剩余,但![]() 大于
大于![]() 水解程度,则等体积混合后溶液呈酸性,所以向混合液中滴入石蕊试液呈红色,故C正确;
水解程度,则等体积混合后溶液呈酸性,所以向混合液中滴入石蕊试液呈红色,故C正确;
D.氨水的电离方程式为:![]() ,当向氨水中加入硫酸铵时,硫酸铵中含有铵根离子,导致氨水的电离平衡向逆反应方向移动,溶液中氢氧根离子浓度降低,氨水的浓度增大,铵根离子浓度增大,平衡常数Kb不变,则溶液中
,当向氨水中加入硫酸铵时,硫酸铵中含有铵根离子,导致氨水的电离平衡向逆反应方向移动,溶液中氢氧根离子浓度降低,氨水的浓度增大,铵根离子浓度增大,平衡常数Kb不变,则溶液中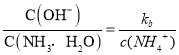 减小,故 D错误。
减小,故 D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A.苯、甲苯互为同系物,都能使酸性高锰酸钾褪色
B.二氯丁烷的同分异构体为8种(不考虑立体异构)
C.乙烯中含有碳碳双键,苯中不含有碳碳双键,但两者均可以发生加成反应
D.饱和硫酸铜和饱和硫酸铵都能使蛋白质溶液产生沉淀,其原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )
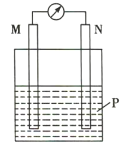
选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 锌 | 稀硫酸 |
C | 银 | 锌 | AgNO3溶液 |
D | 铜 | 铁 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1mol I2(g),发生反应H2(g)+I2(g)![]() 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,该温度下,在另一个容积为2L的密闭容器中充入1molHI(g)发生反应HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g),则下列判断正确的是( )
I2(g),则下列判断正确的是( )
A.后一反应的平衡常数为1
B.后一反应的平衡常数为0.5
C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1
D.后一反应达到平衡时,HI(g)的平衡浓度0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
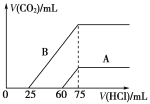
(1)原NaOH溶液的物质的量浓度为____________mol/L。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是____________,其物质的量之比为__________。
(3)曲线B表明,所得溶液加盐酸后产生CO2气体体积(标况)的最大值为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(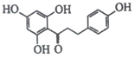 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
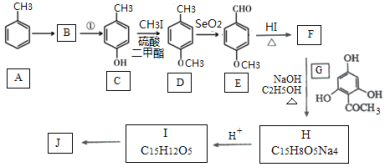
已知:
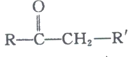 +R’’CHO
+R’’CHO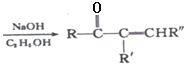 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
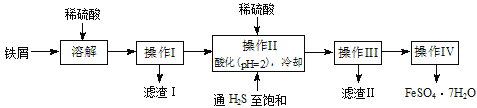
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________________。
(3)操作IV的顺序依次为:_________________、冷却结晶、__________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________。
②判断此滴定实验达到终点的方法是_______________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_________(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com