

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
分析 由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性氧化物属于共价化合物;
C.非金属性越强,氢化物越稳定;
D.高氯酸是酸性最强的含氧酸.
解答 解:由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->F-,故A错误;
B.二氧化硫、三氧化硫都是非金属性氧化物,属于共价化合物,故B正确;
C.非金属性Y>M>Z,故氢化物越稳定Y>M>Z,故C错误;
D.高氯酸是酸性最强含氧酸,F没有最高价含氧酸,所以三种元素中,M的最高价氧化物对应的水化物酸性最强,故D正确,
故选BD.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握元素周期律及微粒半径比较规律.


科目:高中化学 来源: 题型:选择题
| A. | 甲醛 | B. | 乙醛 | C. | 甲酸 | D. | 乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
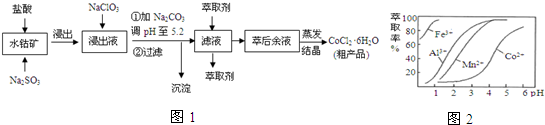
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| B. | 醋酸和硬脂酸互为同系物,C2H4和C18H38也互为同系物 | |
| C. | 有机物W(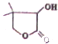 )和其水解产物都可以发生消去反应 )和其水解产物都可以发生消去反应 | |
| D. | 乙烯的加成反应及与酸性KMnO4溶液作用,都与其分子内碳碳双健有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
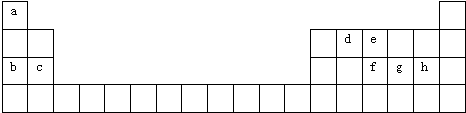
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
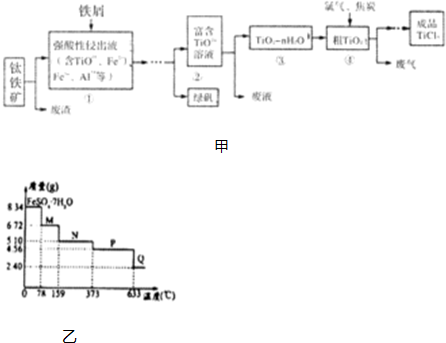
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com