
 葡萄可用于酿酒.
葡萄可用于酿酒. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为90: |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol, 生成的H2O5.4g. 有机物E的分子式C3H6O3 |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基; | ③E的结构简式CH3CH(OH)COOH |
分析 (1)葡萄糖含有醛基,与新制氢氧化铜反应生成Cu2O;
(2)葡萄糖在酒化酶作用下生成酒精与二氧化碳;
(3)①乙酸与乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯与水;
②试管b中盛放的试剂是饱和碳酸钠溶液,吸收未反应的乙酸、乙醇,降低乙酸乙酯溶解;
③试管b中的导管直接伸入液面下,装置内压强减小,可能发生倒吸危险;
(4)同温同压下,气体密度之比等于其相对分子质量之比,可知有机物相对分子质量为90,该有机物完全燃烧生成二氧化碳与水,碱石灰增重14.2g为生成的水与部分二氧化碳的质量,10.0g白色沉淀为生成的碳酸钙,产生4.48L无色无味气体(标准状况)为碱石灰吸收的二氧化碳的体积,计算10g碳酸钙、4.48L二氧化碳的物质的量,计算燃烧生成的n(CO2),计算生成的水的质量,再计算水的物质的量根据原子守恒确定分子中C、H原子数目,解相对分子质量计算分子中氧原子数目,进而确定分子式,结合分子式确定其结构简式.
解答 解:(1)葡萄糖含有醛基,与新制氢氧化铜反应生成Cu2O,产生砖红色沉淀,故答案为:产生砖红色沉淀;
(2)葡萄糖在酒化酶作用下生成酒精与二氧化碳,反应方程式为:C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH,
故答案为:C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH;
(3)①乙酸与乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯与水,反应方程式为:CH3COOH+C2H5OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②试管b中盛放的试剂是饱和Na2CO3溶液,吸收未反应的乙酸、乙醇,降低乙酸乙酯溶解,
故答案为:Na2CO3;
③试管b中的导管直接伸入液面下,装置内压强减小,可能发生倒吸危险,试管b中的导管不伸入液面下的原因是:防止溶液倒吸,
故答案为:防止溶液倒吸;
(4)①该有机物蒸汽密度是相同条件下H2的45倍,故有机物的相对分子质量为45×2=90,故答案为:90;
②碱石灰增重14.2g为生成的水与部分二氧化碳的质量,10.0g白色沉淀为生成的碳酸钙,产生4.48L无色无味气体(标准状况)为碱石灰吸收的二氧化碳的体积,故碱石灰吸收的二氧化碳的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,碳酸钙的物质的量为$\frac{10g}{100g/mol}$=0.1mol,故生成的二氧化碳的总的物质的量为0.2mol+0.1mol=0.3mol,生成的水的质量为14.2g-0.2mol×44g/mol=5.4g,水的物质的量为$\frac{5.4g}{18g/mol}$=0.3mol;
有机物E的物质的量为$\frac{9g}{90g/mol}$=0.1mol,故分子中N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.3mol×2}{0.1mol}$=5,则分子中N(O)=$\frac{90-12×3-6}{16}$=3,故有机物E的分子式为C3H6O3,
故答案为:0.3;5.4;C3H6O3;
③经红外光谱测定,证实其中含有羟基,羧基,甲基,则E的结构简式为:CH3CH(OH)COOH,
故答案为:CH3CH(OH)COOH;
④E与足量Na的化学方程式:CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑,
故答案为:CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑;
⑤E与NaHCO3溶液反应的化学方程式:HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑,
故答案为:HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
点评 本题考查有机物分子式与结构简式确定、乙酸乙酯制备、官能团的结构与性质等,属于拼合型题目,掌握燃烧法利用原子守恒确定有机物分子式,难度中等.


科目:高中化学 来源: 题型:选择题
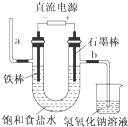
| A. | 装置中,a管能产生氢气 | |
| B. | 在石墨棒电极区域有NaOH产物 | |
| C. | b管导出的是氯气 | |
| D. | 以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
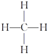 ,下列关于其结构的叙述中,正确的是( )
,下列关于其结构的叙述中,正确的是( )| A. | 甲烷分子是正方形结构 | B. | 甲烷分子是正四面体结构 | ||
| C. | 甲烷分子是极性分子 | D. | 甲烷分子的四个键不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
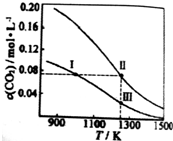
| A. | 反应CO2(g)+c(s)?2CO(g)△H<0 | |
| B. | 反应速率:V逆(状态Ⅰ)>V逆(状态Ⅲ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 体系的压强:2P总(状态Ⅰ)>P总(状态Ⅱ)>P总(状态Ⅰ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
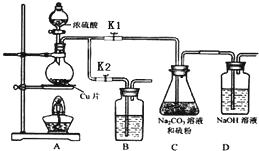 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com