
分析 n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,Cu失去电子数=转移电子数,结合电子守恒可知被还原的硝酸及生成NO,以此来解答.
解答 解:Cu+HNO3=Cu(NO3)2+NO↑+H2O中Cu由0升高为+2价,N元素的化合价由+5价降低为+2价,由电子、原子守恒可知反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,转移电子为0.3mol×(2-0)=0.6mol,被还原的硝酸为$\frac{0.6mol}{(5-2)}$=0.2mol,结合N原子守恒可知生成NO气体的体积为0.2mol×22.4L/mol=4.48L,
答:反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,有19.2克铜参加反应,转移电子为0.6mol,被还原的HNO3为0.2mol,生成的气体体积为4.48L.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化、电子及原子守恒为解答本题关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
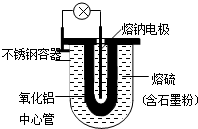 1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
1966年美国福特汽车公司首次发表了Na-S电池的有关报导.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的负极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;GCO(NH2)2.
;GCO(NH2)2.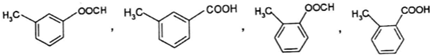 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>R>W | |
| B. | 气态氢化物稳定性:HmW>HnR | |
| C. | XW4分子中各原子均满足8电子结构 | |
| D. | Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com