
| A. | 蒸发溶剂 | B. | 升高温度 | C. | 降低温度 | D. | 加入KN03固体 |
科目:高中化学 来源: 题型:推断题
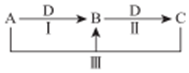 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②⑤⑥ | C. | ③⑤⑥④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 25℃时,Mg(OH)2固体在20mL 0.01mol•L-1氨水中的KSP比在20mL 0.01mol•L-1NH4Cl溶液中的KSP小 | |
| C. | pH试纸测得新制氯水的pH为4.5 | |
| D. | NaHCO3溶液加热蒸干灼烧,得NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只测定它的C、H比 | |
| B. | 只需证明它完全燃烧后产物只有H2O和CO2 | |
| C. | 只测定其燃烧产物中H2O与CO2的物质的量的比值 | |
| D. | 测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 16gO2和O3的混合气体中所含的原子数为NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-离子的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com