
有![]() 和
和![]() 混合溶液30mL,其中
混合溶液30mL,其中![]() 的物质的量浓度为0.1
mol/L。投入少量锌粉充分反应,反应后测得溶液中不含Cu2+,尚余下的Fe2+的物质的量是溶液中Zn2+的物质的量的一半,则投入的锌粉质量是( )
的物质的量浓度为0.1
mol/L。投入少量锌粉充分反应,反应后测得溶液中不含Cu2+,尚余下的Fe2+的物质的量是溶液中Zn2+的物质的量的一半,则投入的锌粉质量是( )
A.0.065g B.0.13g C.1.3g D.10.25g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
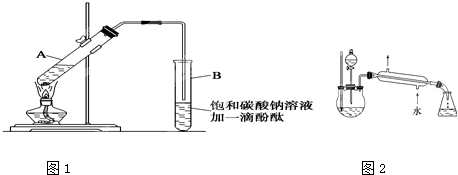
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
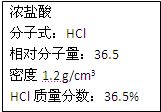 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅蓄电池是最常见的二次电池,正极板上覆盖有铅 | B、25℃时,将20mL 0.1mol/L的H2SO4溶液和30mL 0.1mol/L的NaOH溶液混合,则混合溶液的pH>7 | C、向2mL浓度均为 1mol/L的MgCl2和FeCl3混合溶液中滴加2滴1mol/L的NaOH溶液,立即看到白色沉淀 | D、浓度均为0.1mol/L的CH3COOH和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.0.065g B.0.13g C.1.3g D.10.25g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com