


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 | B、224.0 |
| C、518.8 | D、494 |
查看答案和解析>>
科目:高中化学 来源: 题型:
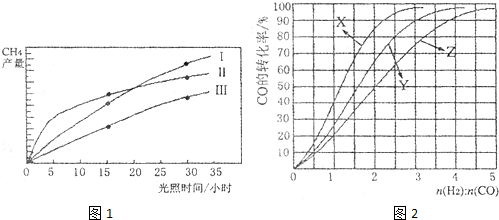
查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+ ![]() O 2(g)
O 2(g) ![]() CO2(g) ΔH=-282.9 kJ·mol-1。
CO2(g) ΔH=-282.9 kJ·mol-1。
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成
A.2∶1 B.1∶
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三下学期开学质量检测化学试卷 题型:填空题
(14分)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
已知:① CH4 (g) + H2O (g) = CO (g)+3H2 (g) △H1=+206.2kJ·mol-1
② CH4(g)+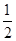 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g) + 2H2O (g) =CO2 (g) +4H2 (g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为 。
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为 (填序号),其原因是 。
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac + CO + NH3  [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是 。
(4)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。持续通入甲烷,在标准状况下,消耗甲烷体积VL。
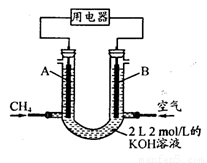
① O<V≤44.8 L时,电池总反应方程式为 ;
② 44.8 L<V≤89.6 L时,负极电极反应为 ;
③ V=67.2 L时,溶液中离子浓度大小关系为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三第一次模拟考试试题(理综)化学部分 题型:填空题
(14分)
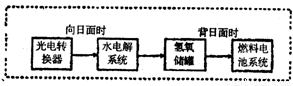
I.我国即将建成自己的载人空间站。载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。
⑴某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的某极反应为:4OH--4e-=O2↑+2H2O,则另一极反应为: 。
⑵有人提出,可以设计某温度下的反应:2CO=2C+O2(△H>O、△S<O)来消除CO的污染。请你判断该温度下上述反应是否能发生并说明理由是 。
Ⅱ.大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
⑴有关大气固氮(以N2+O2 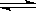 2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2 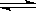 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数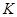 的值如下表。
的值如下表。
|
反应 |
N2+02
|
N2+3H2 |
||
|
温度/℃ |
27 |
2000 |
100 |
400 |
|
K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是 。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
⑵已知:N2(g)+3H2(g) 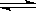 2NH3(g)
2NH3(g) 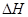 =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)=2H20(1)
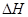 =-571.6 kJ·mol-1
=-571.6 kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的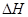 = KJ·mol-1。
= KJ·mol-1。
⑶某研究小组在673 K、30 MPa下,在体积为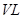 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g) 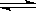 2NH3(g),其
(H2)和 (NH3)随时间变化的关系如图所示。
2NH3(g),其
(H2)和 (NH3)随时间变化的关系如图所示。

①下列叙述正确的是 。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则 (H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示) (H2)= 。
③若开始时 (N2)= (H2),则反应的平衡常数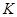 =
(用代数式表示)。
=
(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com