
| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | A | B | C | D | E | F | G | H | I |
| 原子半径/nm | 0.037 | 0.071 | 0.074 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高或最 低化合价 | +1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第30min时,A的反应速率为0.05 mol•L-1•min-1 | |
| B. | 30min内,C的平均反应速率为0.02 mol•L-1•min-1 | |
| C. | 30min内,V(B)=$\frac{1}{3}$V(A) | |
| D. | 30min内,该反应放出的热量为3b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.
某工艺原理示意图如下.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | Na2SO4溶液 | C. | 溴水 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
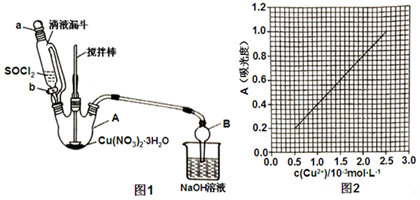
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com