
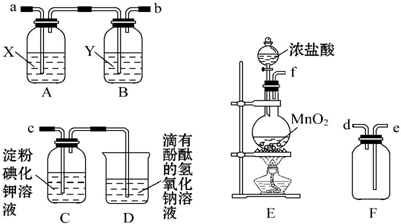
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
分析 (1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,据此答题;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,据此判断实验目的;浓度越大,反应速率越快,需要的时间则越小;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,据此答题;
(3)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(4)通过对比实验进行验证,生成的SO42-对反应起催化作用,则在其中一个实验中先进入硫酸钠,根据反应速率进行判断.
解答 解:(1)NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色,说明产物中有碘单质生成,由于有第一步反应IO3-+3HSO3-=3SO42-+3H+-+I-,且KIO3溶液过量,所以能产生碘单质的反应为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(2)根据表格,对比①②的数据,可以看出KIO3的浓度不一样,所以实验①②是探究浓度对反应速率的影响;由于浓度越大,反应速率越快,则t2较小;
实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以a=10.0、b=4.0,
故答案为:KIO3溶液的浓度;>;10.0;4.0;
(3)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:生成的I-或H+对反应起催化作用;
(4)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:Na2SO4粉末;=;<.
点评 本题考查了探究影响化学反应速率的因素的方法,题目难度中等,明确实验目的及对比实验的设计方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握温度、催化剂、浓度等因素对化学反应速率的影响.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
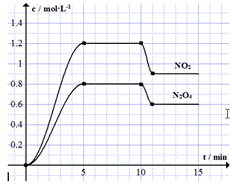 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于分解反应、放热反应 | |
| B. | 该反应瞬间能产生大量高温气体,推动飞船飞行 | |
| C. | 该反应把化学能转变为热能和动能 | |
| D. | 该反应反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取滤渣加入稀氨水中,不能溶解 | |
| B. | 取滤渣加入NaOH溶液中,能溶解 | |
| C. | 取滤渣加入稀盐酸中,能溶解 | |
| D. | 将滤渣平分成两等份,分别加入NaOH溶液和稀盐酸中,均能溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com