
(9分)潜在储氢材料――化合物 A 是第二周期两种氢化物形成的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温下为白色晶体,稳定而无毒。刚刚融化的 A 缓慢释放氢气,转变为化合物B(乙烯的等电子体)。B 不稳定,易聚合成聚合物 C(聚乙烯的等电子体)。C 在155oC释放氢气转变为聚乙炔的等电子体,其中聚合度为3的化合物 D 是苯的等电子体。高于500oC时 D 释放氢气,转变为化合物 E,E 有多种晶型。
6-1 写出 A、B、C、D、E 的化学式。
6-2 化合物 A 转变为 E 各步释放的氢所占的质量分数以及总共释放的氢气所占的质量分数多大?
6-3 为使 A 再生,有人设计了化合物 D 在水蒸气存在下与甲烷反应,写出化学方程式。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:阅读理解
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.

| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
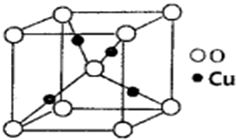 某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.
某催化剂中含有的活性组分为Ni、Cu和Zn的化合物,可用于二氧化碳加氢制取甲醚.甲醚是乙醇的同分异构体,其熔点-141.5℃,沸点-24.9℃,在加热条件下可分解成甲烷、乙烷、甲醛等.

查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学必修2 2.4太阳能、生物能和氢能的利用练习卷(解析版) 题型:推断题
潜在储氢材料——化合物 A 是第二周期两种氢化物间通过配位键形成的化合物,是乙烷的等电子体,相对分子质量30.87,常温下为白色晶体,稳定而无毒。刚刚融化的 A 缓慢释放氢气,转变为化合物B(乙烯的等电子体)。B 不稳定,易聚合成聚合物 C(聚乙烯的等电子体)。C 在155oC释放氢气转变为X(聚乙炔的等电子体),其中聚合度为3的化合物 D 是苯的等电子体。高于500oC时 D 释放氢气,转变为化合物 E,E 有多种晶型,有类似金刚石的原子晶体,也有类似于石墨的片层结构的过渡型晶体。
(1) 写出 A、B、C、D、E 的化学式。
(2)为使 A 再生,有人设计了化合物 D 在水蒸气存在下与甲烷反应,写出化学方程式。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com