
| ||
| 87g×1.12L |
| 22.4L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
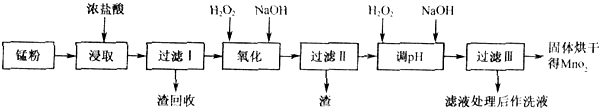
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
查看答案和解析>>
科目:高中化学 来源:广东省惠州市2011届高三第一次调研考试(理综)化学部分 题型:填空题
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:广东省惠州市2010-2011学年高三第一次调研考试(理综)化学部分 题型:填空题
(16分)回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:

|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)2 |
8.3 |
9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
回收的废旧锌锰干电池经过处理后可得到锰粉(主要含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤和数据如下:

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)2 | 8.3 | 9.8 |
(1)在加热条件下,用浓盐酸浸取锰粉得到含有Mn2+、Fe3+等离子的溶液,MnO2与浓盐酸反应的离子方程式 ,该处理方法的缺点 。
(2)步骤I中滤渣的化学式 ,步骤I中滤渣的化学式 。
(3)向步骤I的滤液中加足量H2O2的作用为 。再加NaOH溶液调节pH在3.7<pH<8.3,目的是 。
(4)向步骤II的滤液中H2O2溶液,再加NaOH溶液调节pH为9,使Mn2+转化成MnO2,在这一过程中H2O2起 (填氧化剂、还原剂)的作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com