
| A | B | ||
| C | D |
| A. | A、C、D的最高价氧化物对应水化物的酸性强弱顺序:D>C>A | |
| B. | B和C形成的化合物具有两性 | |
| C. | C的阳离子与B的阴离子的电子层结构不同 | |
| D. | D元素的最简单氢化物的热稳定性大于B元素的最简单氢化物 |
分析 由短周期元素A、B、C、D在元素周期表中的相对位置,A、B处于第二周期,C、D处于第三周期,令A的质子数为x,则D的质子数为x+10,则x+x+10=22,解得x=6,故A为碳元素,可推知B为O元素、C为Al、D为S元素;
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.B是O、C是Al元素,氧化铝具有两性;
C.C的阳离子有2层电子、B的阴离子有两层电子;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:由短周期元素A、B、C、D在元素周期表中的相对位置,A、B处于第二周期,C、D处于第三周期,令A的质子数为x,则D的质子数为x+10,则x+x+10=22,解得x=6,故A为碳元素,可推知B为O元素、C为Al、D为S元素.
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>C>Al,A、C、D的最高价氧化物对应水化物分别为碳酸、氢氧化铝、硫酸,所以酸性:硫酸>碳酸>氢氧化铝,故A错误;
B.B和C形成的化合物为氧化铝,氧化铝能溶于强酸、强碱溶液生成盐和水,所以属于两性氧化物,故B正确;
C.Al3+离子与O-离离子核外电子数均为10,离子的电子层结构相同,故C错误;
D.元素的非金属性越强,其氢化物越稳定,非金属性B(O)>D(S),故氢化物稳定性H2O>H2S,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握同主族元素原子序数之间的关系,知道非金属性强弱判断方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
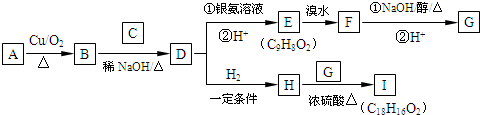
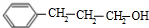 +
+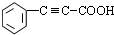 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.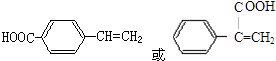 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和水,甲醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com