
���� ���ɢ�CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ��١�2-�ڿɵã�2CO��g��+O2��g����2CO2��g����
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��
��� �⣺��1���ɢ�CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol
��2H2O ��g���T2H2��g��+O2��g����H=+484kJ/mol��
���ݸ�˹���ɣ��١�2-�ڿɵã�2CO��g��+O2��g����2CO2��g����H=-566 kJ/mol��
�ʴ�Ϊ��2CO��g��+O2��g����2CO2��g����H=-566 kJ/mol��
��ƽ��ʱCO��O2��CO2�����ʵ����ֱ�Ϊ4mol��2mol����4mol�������¶Ⱥ�ѹǿ���䣬���������ʵ���֮��Ϊ2��1��2ʱ����ƽ��״̬��
A��CO��O2��CO2�����ʵ����ֱ�Ϊ5mol��2.5mol��5molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����A��ȷ��
B�����ʵ������ӱ� CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����B����
C��CO��O2��CO2�����ʵ����ֱ�Ϊ3mol��1.5mol��3molʱ����ƽ��״̬��������1mol��ЧΪǰ��ƽ��Ļ���������0.5molO2��ƽ�������ƶ�����C����
D�����ʵ��������룬CO��O2��CO2��Ũ��֮����ԭƽ����ͬ��2��1��2��ƽ�ⲻ�ƶ�����D����
�ʴ�Ϊ��A��
���� ���⿼���Ȼ�ѧ����ʽ��д��ƽ���ƶ���Ϊ�߿��������ͣ�������ѧ���ķ��������������Ѷ��еȣ�


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
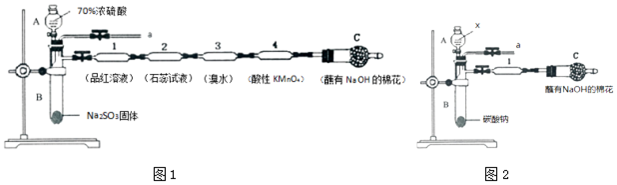
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
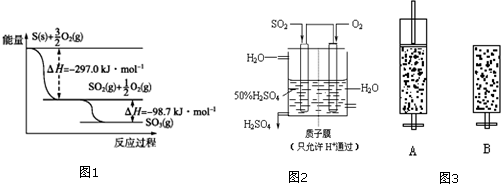
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
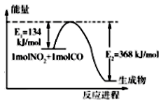 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣮
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���ش��������⣮| �¶ȣ�K�� | ƽ��ʱNH3�����ʵ�����mol�� |
| T1 | 2.4 |
| T2 | 2.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
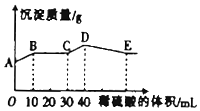 ����NaOH��BaCl2��Al2��SO4��3���ֹ�����ɵĻ��������������ˮ�У�����ܽ⣬����Һ�еμ�1mol•L-1��ϡ���ᣬ����ϡ�������������ɳ�����������ϵ��ͼ��ʾ�������й��жϲ���ȷ���ǣ�������
����NaOH��BaCl2��Al2��SO4��3���ֹ�����ɵĻ��������������ˮ�У�����ܽ⣬����Һ�еμ�1mol•L-1��ϡ���ᣬ����ϡ�������������ɳ�����������ϵ��ͼ��ʾ�������й��жϲ���ȷ���ǣ�������| A�� | AB�η�����Ӧ�����ӷ���ʽΪ��Ba2++SO42-�TBaSO4�� | |
| B�� | E���Ӧ������ϡ��������Ϊ70mL | |
| C�� | D���ʾ�ij����Ļ�ѧʽΪAl��OH��3��BaSO4 | |
| D�� | E�������A�����������2.33g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
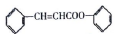 �Ǻϳɸ߾۷�����ԭ�ϣ���ϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��
�Ǻϳɸ߾۷�����ԭ�ϣ���ϳ�·�ߣ����ַ�Ӧ������ȥ����ͼ��ʾ��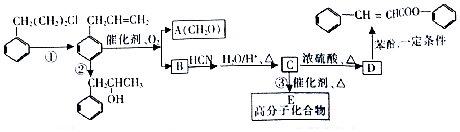
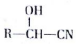 $��_{��}^{H_{2}O/H+}$
$��_{��}^{H_{2}O/H+}$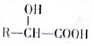
 $��_{��}^{����}$
$��_{��}^{����}$ +nH2O��
+nH2O�� ����дһ�֣���
����дһ�֣���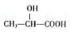 ����·�ߣ������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪA$\stackrel{��Ӧ�Լ�}{��}$B��$\stackrel{��Ӧ�Լ�}{��}$Ŀ����
����·�ߣ������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪA$\stackrel{��Ӧ�Լ�}{��}$B��$\stackrel{��Ӧ�Լ�}{��}$Ŀ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com