
ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬Ģå»ż¾łĪŖ1 LµÄĖÄøöĆܱÕČŻĘ÷ÖŠ£¬±£³ÖĪĀ¶ČŗĶČŻ»ż²»±ä£¬ŅŌĖÄÖÖ²»Ķ¬µÄĶ¶ĮĻ·½Ź½½ųŠŠ·“Ó¦”£Ę½ŗāŹ±ÓŠ¹ŲŹż¾ŻČēĻĀ(ŅŃÖŖ2SO2(g)£«O2(g) 2SO3(g)¦¤H£½£196.6 kJ”¤mol£1)”£
2SO3(g)¦¤H£½£196.6 kJ”¤mol£1)”£
ČŻĘ÷ | ¼× | ŅŅ | ±ū | ¶” |
ĘšŹ¼Ķ¶ĮĻĮæ | 2 mol SO2£«1 mol O2 | 1 mol SO2£«0.5 mol O2 | 2 mol SO3 | 2 mol SO2£«2 mol O2 |
·“Ó¦·Å³ö»ņĪüŹÕµÄČČĮæ(kJ) | a | b | c | d |
Ę½ŗāŹ±c(SO3) (mol”¤L£1) | e | f | g | h |
ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ( )
A£®a£½c£»e£½g B£®a>2b£»e>2f C£®a>d£»e>h D£®c£«98.3e>196.6
 °ŁÄźŃ§µäæĪŹ±Ń§Į·²āĻµĮŠ“š°ø
°ŁÄźŃ§µäæĪŹ±Ń§Į·²āĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗÓÄĻŹ”øßČżÉĻµŚĪå“ĪÖÜĮ·»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
øõŹĒÓĆĶ¾¹ć·ŗµÄ½šŹōŌŖĖŲ£¬µ«ŌŚÉś²ś¹ż³ĢÖŠŅײśÉśÓŠŗ¦µÄŗ¬øõ¹¤Ņµ·ĻĖ®”£
£Ø1£©»¹Ō³Įµķ·ØŹĒ“¦Ąķŗ¬Cr2O72£ŗĶCrO42£¹¤Ņµ·ĻĖ®µÄŅ»ÖÖ³£ÓĆ·½·Ø£¬Ę乤ŅÕĮ÷³ĢĪŖ£ŗ
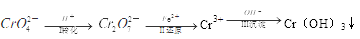
ĘäÖŠµŚ¢ń²½“ęŌŚĘ½ŗā£ŗ2Cr2O42££Ø»ĘÉ«£©£«2H£« Cr2O72££Ø³ČÉ«£©£«H2O
Cr2O72££Ø³ČÉ«£©£«H2O
¢ŁČōĘ½ŗāĢåĻµµÄpH£½0£¬øĆČÜŅŗĻŌ__________É«”£
¢Śøł¾Ż 2Cr2O42££Ø»ĘÉ«£©£«2H£« Cr2O72££Ø³ČÉ«£©£«H2OÉč¼ĘČēĶ¼×°ÖĆ£Ø¾łĪŖ¶čŠŌµē¼«£©µē½āNa2CrO4ČÜŅŗÖĘČ”Na2Cr2O7”£Na2Cr2O7ÖŠøõŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ_________£¬Ķ¼ÖŠÓŅ²ąµē¼«Į¬½ÓµēŌ“µÄ_________¼«£¬Ęäµē¼«·“Ó¦Ź½ĪŖ_________________”£
Cr2O72££Ø³ČÉ«£©£«H2OÉč¼ĘČēĶ¼×°ÖĆ£Ø¾łĪŖ¶čŠŌµē¼«£©µē½āNa2CrO4ČÜŅŗÖĘČ”Na2Cr2O7”£Na2Cr2O7ÖŠøõŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ_________£¬Ķ¼ÖŠÓŅ²ąµē¼«Į¬½ÓµēŌ“µÄ_________¼«£¬Ęäµē¼«·“Ó¦Ź½ĪŖ_________________”£
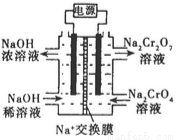
¢ŪµŚ¢ņ²½·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________________________”£
£Ø2£©CrO3¾ßÓŠĒæŃõ»ÆŠŌ£¬Óöµ½ÓŠ»śĪļ£ØČē¾Ę¾«£©Ź±£¬ĆĶĮŅ·“Ó¦ŅŌÖĮ×Å»š”£ČōøĆ¹ż³ĢÖŠŅŅ“¼±»Ńõ»Æ³ÉŅŅĖį£¬CrO3±»»¹Ō³ÉĀĢÉ«µÄCr2(SO4)3”£Ķź³ÉøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ

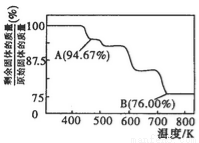
£Ø3£©CrO3µÄČČĪČ¶ØŠŌ½Ļ²ī£¬¼ÓČČŹ±Öš²½·Ö½ā£¬Ęä¹ĢĢ岊ĮōĀŹĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾”£BµćŹ±Ź£Óą¹ĢĢåµÄ³É·ÖŹĒ____________£ØĢī»ÆѧŹ½£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗžÄĻŹ”ø߶žÉĻµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
A”¢B”¢C”¢D”¢E¾łĪŖÓŠ»ś»ÆŗĻĪļ£¬AŹĒ·Ö×ÓŹ½ĪŖC5H10OµÄÖ±Į“»ÆŗĻĪļ£¬BÓėNaHCO3ČÜŅŗĶźČ«·“Ó¦£¬ĘäĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ2£¬ĖüĆĒÖ®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ØĢįŹ¾£ŗRCH=CHR”äŌŚĖįŠŌøßĆĢĖį¼ŲČÜŅŗÖŠ·“Ӧɜ³ÉRCOOHŗĶR”äCOOH£¬ĘäÖŠRŗĶR”äĪŖĶ黳£©”£ĻĀĮŠŠšŹö“ķĪóµÄŹĒ£Ø £©

A£®BµÄ½į¹¹¼ņŹ½ĪŖHOOC©CH2©COOH
B£®CÓė ŅŅ“¼·¢ÉśĮĖõ„»Æ·“Ó¦
ŅŅ“¼·¢ÉśĮĖõ„»Æ·“Ó¦
C£®AµÄ½į¹¹¼ņŹ½ŹĒCH3©CH£ØOH£©©CH=CH©CH3
D£®EµÄ·Ö×ÓŹ½ĪŖC3H2O4Na2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«Ź”øßŅ»ĻĀĘŚÄ©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ČēÓŅ±ķĖłŹ¾µÄĪåÖÖŌŖĖŲÖŠ£¬W”¢X”¢Y”¢ZĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ÕāĖÄÖÖŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ22”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
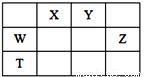
A. X”¢Y”¢ZČżÖÖŌŖĖŲ×īµĶ¼ŪĒā»ÆĪļµÄ·ŠµćŅĄ“ĪÉżøß
B. ÓÉX”¢YŗĶĒāČżÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠÓŠ¹²¼Ū¼ü
C. ĪļÖŹWY2”¢W3X4¾łÓŠČŪµćøß”¢Ó²¶Č“óµÄĢŲŠŌ
D. TŌŖĖŲæĻ¶ØŹĒ½šŹōŌŖĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”ø߶žÉĻµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ŌŚŅ»¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬½ųŠŠČēĻĀ»Æѧ·“Ó¦£ŗCO£Øg£©+H2O£Øg£© CO2£Øg£©+H2£Øg£© £¬Ęä»ÆŃ§Ę½ŗā³£ŹżKŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
CO2£Øg£©+H2£Øg£© £¬Ęä»ÆŃ§Ę½ŗā³£ŹżKŗĶĪĀ¶ČtµÄ¹ŲĻµČēĻĀ±ķ£ŗ
t”ę | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆ·“Ó¦ĪŖ__________·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©£®
£Ø2£©ÄÜÅŠ¶ĻøĆ·“Ó¦ŹĒ·ń“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ______________£Ø¶ąŃ”æŪ·Ö£©£®
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠ c£ØCO£©²»±ä
C£®¦ŌÕż£ØH2£©=¦ŌÄę£ØH2O£© D£®c£ØCO2£©=c£ØCO£©
£Ø3£©850”ę Ź±£¬ČōĻņŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠĶ¬Ź±³äČė1.0molCO”¢3.0molH2O”¢1.0molCO2
ŗĶxmolH2£¬Ōņ£ŗ
µ±x£½5.0Ź±£¬ÉĻŹöĘ½ŗāĻņ____________£ØĢī”°Õż·“Ó¦”±”¢”°Äę·“Ó¦”±”¢”°Ē”ŗĆĘ½ŗā”±£©·½Ļņ½ųŠŠ£®
¢Ś ČōŅŖŹ¹ÉĻŹö·“Ó¦æŖŹ¼Ź±ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬ŌņxÓ¦Āś×ćµÄĢõ¼žŹĒ_________________£®
£Ø4£©ŌŚ850”ꏱ£¬ČōÉčx=5.0molŗĶx=6.0mol£¬ĘäĖūĪļÖŹµÄĶ¶ĮĻ²»±ä£¬µ±ÉĻŹö·“Ó¦“ļµ½Ę½ŗāŗó£¬
²āµĆH2µÄĢå»ż·ÖŹż·Ö±šĪŖa£„”¢b% £¬Ōņa _________ b £ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”ø߶žÉĻµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚ¼×ĖįµÄĻĀĮŠŠŌÖŹÖŠ£¬æÉŅŌÖ¤Ć÷ĖüŹĒČõµē½āÖŹµÄŹĒ£Ø £©
A£®1mol/LµÄ¼×ĖįČÜŅŗÖŠc£ØH+£©Ō¼ĪŖ0.01mol/L
B£®¼×ĖįÓė»īĘĆ½šŹō·“Ӧɜ³ÉĒāĘų
C£®10mL1mol/LµÄ¼×ĖįĒ”ŗĆÓė10mL1mol/LµÄNaOHČÜŅŗĶźČ«·“Ó¦
D£®ŌŚĻąĶ¬ÅضČĻĀ£¬¼×ĖįµÄµ¼µēŠŌ±Č¶žŌŖĒæĖįČÜŅŗµÄČõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”ø߶žÉĻµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Óė“æĖ®µÄµēĄėĻąĖĘ£¬Ņŗ°±ÖŠŅ²“ęŌŚ×ÅĪ¢ČõµÄµēĄė£ŗ2NH3 NH4++NH2-¾Ż“ĖÅŠ¶ĻŅŌĻĀŠšŹöÖŠ“ķĪóµÄŹĒ£Ø £©
NH4++NH2-¾Ż“ĖÅŠ¶ĻŅŌĻĀŠšŹöÖŠ“ķĪóµÄŹĒ£Ø £©
A£®Ņŗ°±ÖŠŗ¬ÓŠNH3”¢NH4+”¢NH2-µČĪ¢Į£
B£®Ņ»¶ØĪĀ¶ČĻĀŅŗ°±ÖŠc£ØNH4+£©”¤c£ØNH2-£©ŹĒŅ»øö³£Źż
C£®Ņŗ°±µÄµēĄė“ļµ½Ę½ŗāŹ±c£ØNH3£©=c£ØNH4+£©=c£ØNH2-£©
D£®Ö»ŅŖ²»¼ÓČėĘäĖūĪļÖŹ£¬Ņŗ°±ÖŠc£ØNH4+£©=c£ØNH2-£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓ±±Ź”øßŅ»ÉĻČėŃ§æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
Ä³Ń§ÉśÓūÅäÖĘ6.0mol/LµÄH2SO41000mL£¬ŹµŃéŹŅÓŠČżÖÖ²»Ķ¬ÅØ¶ČµÄĮņĖį£ŗ¢Ł480mL 0.5mol/L µÄĮņĖį£»¢Ś150mL 25%µÄĮņĖį£Ø¦Ń=1.18g/mL£©£»¢Ū×ćĮæµÄ18mol/LµÄĮņĖį£®ÓŠČżÖÖ¹ęøńµÄČŻĮæĘæ£ŗ250mL”¢500mL”¢1000mL£®ĄĻŹ¦ŅŖĒó°Ń¢Ł¢ŚĮ½ÖÖĮņĖįČ«²æÓĆĶź£¬²»×ćµÄ²æ·ÖÓÉ¢ŪĄ“²¹³ä£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŹµŃéĖłÓĆ25%µÄĮņĖįµÄĪļÖŹµÄĮæÅضČĪŖ mol/L£Ø±£Įō1Ī»Š”Źż£©£®
£Ø2£©ÅäÖĘøĆĮņĖįČÜŅŗӦєÓĆČŻĮæĘæµÄ¹ęøńĪŖ mL£®
£Ø3£©ÅäÖĘŹ±£¬øĆĶ¬Ń§µÄ²Ł×÷Ė³ŠņČēĻĀ£¬Ēė½«²Ł×÷²½ÖčB”¢D²¹³äĶźÕū£®
A£®½«¢Ł¢ŚĮ½ČÜŅŗČ«²æŌŚÉÕ±ÖŠ»ģŗĻ¾łŌČ£»
B£®ÓĆĮæĶ²×¼Č·ĮæČ”ĖłŠčµÄ18mol/LµÄÅØĮņĖį mL£¬ŃŲ²£Į§°ōµ¹ČėÉĻŹö»ģŗĻŅŗÖŠ£®²¢ÓĆ²£Į§°ō½Į°č£¬Ź¹Ęä»ģŗĻ¾łŌČ£»
C£®½«»ģŗĻ¾łŌȵÄĮņĖįŃŲ²£Į§°ō×¢ČėĖłŃ”µÄČŻĮæĘæÖŠ£»
D£® £»
E£®Õńµ“£¬¼ĢŠųĻņČŻĮæĘæÖŠ¼ÓĖ®£¬Ö±µ½ŅŗĆę½Ó½üæĢ¶ČĻß1”«2cm “¦£»
F£®øÄÓĆ½ŗĶ·µĪ¹Ü¼ÓĖ®£¬Ź¹ČÜŅŗµÄ°¼ŅŗĆęĒ”ŗĆÓėæĢ¶ČĻßĻąĒŠ£»
G£®½«ČŻĮæĘæøĒ½ō£¬Õńµ“£¬Ņ”ŌČ£®
£Ø4£©¶ØČŻŹ±ø©ŹÓæĢ¶ČĻߣ¬»įŹ¹ĖłÅäČÜŅŗÅØ¶Č £ØĢī”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°ĪŽÓ°Ļģ”±£©£®
£Ø5£©½ųŠŠ²Ł×÷CĒ°»¹Šč×¢Ņā £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğĮÉÄžŹ”ø߶žĻĀĘŚ³õĆžµ×»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ij»ÆŗĻĪļÓÉĪåÖÖ¶ĢÖÜĘŚŌŖĖŲ×é³É£¬·Ö±šĪŖX”¢Y”¢Z”¢W”¢R£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó”£XŌ×ÓŹĒĖłÓŠŌ×ÓÖŠ°ė¾¶×īŠ”µÄ£¬Y”¢RĶ¬Ö÷×壬Z”¢W”¢RĶ¬ÖÜĘŚ£¬YŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄ3±¶£¬ZŹĒ³£¼ūµÄ½šŹō£¬µē×Ó²ćŹżµČÓŚÖ÷×åŠņŹż£¬Wµ„ÖŹŹĒČĖĄą½«Ģ«ŃōÄÜ×Ŗ±äĪŖµēÄܵij£ÓĆ²ÄĮĻ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ZÓėYŠĪ³ÉµÄ»ÆŗĻĪļŹĒ¹¤ŅµÉĻÖĘČ”ZµÄŌĮĻ
B. WY2æÉÓėĖį·“Ó¦£¬µ«²»ÄÜÓė¼ī·“Ó¦
C. Ō×Ó°ė¾¶°“X”¢Y”¢Z”¢R”¢WµÄĖ³ŠņŅĄ“ĪŌö“ó
D. ČČĪČ¶ØŠŌ £ŗX2R£¾X2Y
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com