
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-)>c(H+) | |
| C. | pH相同的 ①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$增大 |
分析 A、依据硫化钠溶液中存在的质子守恒分析计算判断;
B、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,生成碳酸钠溶液,所以离子浓度大小为:C(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+);C、对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大;
D、溶液中铵根离子浓度增大,抑制了一水合氨的电离.
解答 解:A、依据硫化钠溶液中存在的质子守恒分析,溶液中水完全电离出氢氧根离子和氢离子相同分析得到,c(OH-)=c(H+)+c(HS-)+2c(H2S),故A错误;
B、0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,生成碳酸钠溶液,所以离子浓度大小为:C(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+),故B错误;
C、在相同的条件下测得①CH3COONa ②NaHCO3 ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,所以钠离子的浓度为:①>②>③,故C正确;
D、向0.1mol/L的氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则一水合氨的浓度增大,氢氧根离子的浓度减小,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$减小,故D错误;
故选C.
点评 本题考查看酸碱混合定性判断、溶液酸碱性、溶液中离子浓度大小判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确溶液中离子浓度大小比较的方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
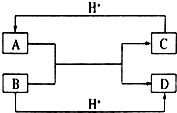 已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):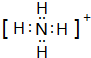 ;D
;D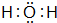 .写出B、C的离子符号或化学式:BOH-;CNH3.
.写出B、C的离子符号或化学式:BOH-;CNH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
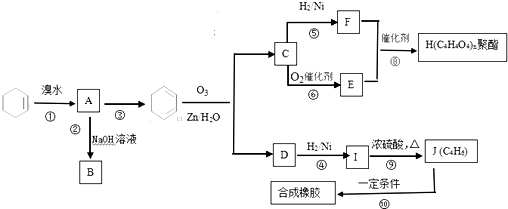
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,乙酸官能团的名称羧基.
,乙酸官能团的名称羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
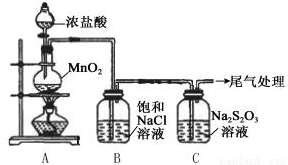
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
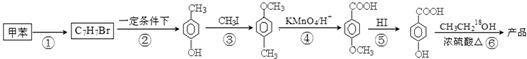
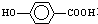 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.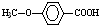 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
.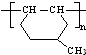 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.001 mol•L-1 | B. | O.002 mol•L-1 | C. | 0.003 mol•L-1 | D. | O.00125 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com