
A、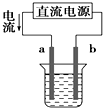 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、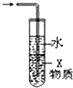 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA | ||
| B、56g的铁发生氧化还原反应,一定失去3NA个电子 | ||
| C、标准状况下,22.4L氟气中所含氟原子数为2NA | ||
D、0.1mol?L-1稀硫酸中含有SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15 g甲基(-CH3)所含电子总数为9NA |
| B、标准状况下,22.4L水中所含有的分子数为NA |
| C、0.8 mol乙烷中含4.8NA个氢原子 |
| D、电解氧化铝时,若阴极生成54g铝,则阳极产生1.5NA个氧气分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g氧气所含分子数为2NA |
| B、在常温常压下,1mol氦气含有的原子数为NA |
| C、在常温常压下,11.2L氯气含有的分子数为0.5NA |
| D、2.3gNa在空气中燃烧时,消耗氧气的分子数为0.025NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的盐酸与pH=10的氨水溶液等体积混合后pH<7 |
| B、25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D、均为0.10mol?L-1 NH4Cl和NH4HSO4溶液,铵根离子浓度前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
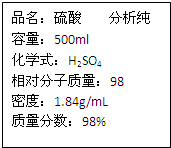 用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)
用标签如图的浓硫酸配得200mL某浓度的稀硫酸,现将27.2g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O |
| B、铁与足量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| C、磁性氧化铁与浓盐酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、溴化亚铁溶液与氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com