
| A. | 常温常压下,48g O2中含氧原子数为3NA | |
| B. | 标准状况下,22.4 L H2O中所含原子数为3NA | |
| C. | 1 mol/L的K2SO4溶液中,含2 NA个K+ | |
| D. | 24g Mg变为Mg2+时失去的电子数为NA |
分析 A、氧气由氧原子构成,根据氧气的物质的量求出氧原子的物质的量,即可求出氧原子的个数;
B、标况下,水为液态;
C、溶液体积不明确;
D、求出镁的物质的量,然后根据镁反应后变为+2价来分析.
解答 解:A、氧气由氧原子构成,故48g氧气中含有的氧原子的物质的量为3mol,故为3NA个,故A正确;
B、标况下,水为液态,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、溶液体积不明确,故溶液中的钾离子的个数无法计算,故C错误;
D、24g镁的物质的量为1mol,而镁反应后变为+2价,故1mol镁失去2NA个电子,故D错误.
故选A.
点评 本题考查了物质的量和阿伏伽德罗常数的有关计算,难度不大,掌握公式的运用和物质结构特点是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
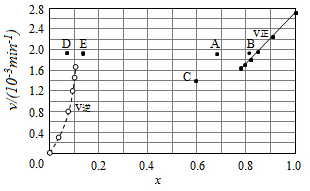 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在的电离平衡为:HCO3-+H2O?H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | HCO3-的电离程度大于HCO3-的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
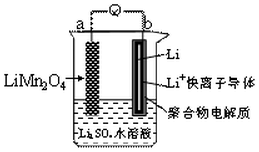 新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )
新能源汽车如(比亚迪秦、唐)相对传统汽车.有一系列的优点.如:环保、加速快(比亚迪唐0-100km/h加速时间仅需4.9秒).而新能源汽车一个核心部件为锂离子电池,如图是我国科学家报道的某种水溶液锂离子电池体系.下列叙述错误的是( )| A. | a为电池的正极 | |
| B. | 电池充电反应为LiMn2O4═Li1-xMn2O4+xLi | |
| C. | 放电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中Li+从b向a迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ CO32- Cl- | B. | H+ SO42- Ba2+ | ||
| C. | K+ H+OH- | D. | Fe3+ Na+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它属于芳香烃 | B. | 分子中所有的碳原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com