
【题目】在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线________(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)3 min内,以X的浓度变化表示的平均反应速率为_____________。
(3)下列措施能使该反应速率加快的是________(用序号回答)。
①升高温度 ②减小容器体积 ③通入N2O4 ④通入Ar使压强增大 ⑤通入HCl气体
(4)下列叙述能说明该反应已达到化学平衡状态的是____________(填标号)。
A.容器内压强不再发生变化
B.混合气体的密度不变
C.容器内混合气体原子总数不变
D.混合气体的平均相对分子质量不变
E.v(NO2)=2v(N2O4)
F.相同时间内消耗n mol的Y的同时消耗2n mol的X
【答案】Y 0.1 mol/(Lmin) ①②③ A、D、F
【解析】
(1)根据相同时间内物质改变的物质的量的比等于化学计量数的比分析判断;
(2)根据v=![]() 计算反应速率;
计算反应速率;
(3)根据化学反应速率的影响因素分析判断;
(4)根据平衡是各种物质的浓度不变、物质的含量不变,反应速率不变分析判断。
(1)根据图示可知:在3 min内X改变的物质的量是0.6 mol,Y改变的物质的量是0.3 mol,n(X):n(Y)=0.6 mol:0.3 mol=2:1,所以X表示NO2,Y表示N2O4;
(2)反应在体积为2 L的密闭容器中进行,在3 min内NO2的物质的量变化了0.6 mol,所以用NO2表示的反应速率v(NO2)= =0.1 mol/(Lmin);
=0.1 mol/(Lmin);
(3)①升高温度,物质的内能增加,更多的分子变为活化分子,活化分子数增加,反应速率加快,①符合题意;
②减小容器体积,使物质的浓度增大,单位体积内活化分子数增加,反应速率加快,②符合题意;
③通入N2O4气体,使物质浓度增大,单位体积内活化分子数增加,反应速率加快,③符合题意;
④通入Ar使压强增大,但不能改变体系内的任何一种物质的浓度,化学反应速率不变,④不符合题意;
⑤通入HCl气体,与反应体系无关,不能改变物质的浓度,反应速率不变,⑤不符合题意;
故合理选项是①②③;
(4) A.该反应在恒容密闭容器中进行,反应前后气体的物质的量发生变化,若容器内压强不再发生变化,说明气体的物质的量不变,反应达到平衡状态,A正确;
B.容器的容积不变,反应混合物都是气体,气体的质量不变,则任何条件下气体的密度都不变,因此不能据此判断反应是否处于平衡状态,B错误;
C.反应混合物都是气体,反应遵循质量守恒定律,气体的质量不变,气体原子数目不变,所以不能据此判断反应是否处于平衡状态,C错误;
D.混合气体的总质量不变,若反应达到平衡状态,则气体的物质的量不变,单位物质的量的气体的质量也不变,气体平均相对分子质量不变,因此可据此判断反应处于平衡状态,D正确;
E.v(NO2)=2v(N2O4)未指明反应速率是正反应速率还是 逆反应速率,因此不能判断平衡状态,E错误;
F.相同时间内消耗n mol的Y就会产生2 n mol的X,同时消耗2n mol的X,则X的物质的量不变,由于容器的容积不变,则反应处于平衡状态,F正确;
故合理选项是A、D、F。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】为验证还原性:SO2>Fe2+>C1-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有

A. 只有甲 B. 甲、乙 C. 甲、丙 D. 甲、乙、丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应方程式不正确的是
A.用Cl2与石灰制取漂白粉:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
B.工业上用焦碳与石英砂制粗硅:SiO2+C![]() Si+CO2
Si+CO2
C.高温下铁与水蒸汽反应:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
D.小苏打溶液与少量石灰水反应:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH (g) ΔH=a kJ·mol1,在不同温度下,K(500℃)=2.5 L2·mol2,K(700℃)=0.2 L2·mol2。
①ΔH________0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2 mol、1 mol、3mol,则此时生成CH3OH的速率____消耗CH3OH的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
i 2CH3OH(g)=C2H4(g)+2H2O(g) ΔH1=-20.9 kJ·mol1
ii3CH3OH(g)=C3H6(g)+3H2O(g) ΔH2=-98.1 kJ·mol1
iii 4CH3OH(g)=C4H8(g)+4H2O(g) ΔH3=-118.1 kJ·mol1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=____。
3C2H4 (g) ΔH4=____。
②加入N2作为稀释剂,反应i中C2H4的产率将_____(增大、减小、不变)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:
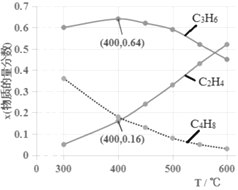
①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是_____________________________;当温度低于400℃时,原因是________________________。
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=________(列式计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为了获得更高的C2H4在产物中的比例,除控制较高温度的条件外,以下较适宜的是______。
A.增加水醇比 B.降低水醇比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+CO(g)![]() CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
A.因该反应为放热反应,故不加热就可发生
B.相同条件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同条件下,反应物2 mol H2和1 mol CO 的总能量一定高于生成物1 mol CH3OH(g)的总能量
D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是:有气体生成,电流计指针发生偏转 |
①通过实验2和3,可得出原电池的形成条件是______________;
②通过实验1和3,可得出原电池的形成条件是_______________;
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是_______;
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________;Cu棒:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为 CuCO3Cu(OH)2、CuSiO32H2O,含 SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O ![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为________________,为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③_________;
(2)滤渣2的主要成分为___________(填化学式);
(3)“氧化”时发生反应的离子方程式为__________________________;
(4)试剂X的作用是调节溶液的pH,试剂X可以是_____;“调pH”时,pH不能过高,其原因是_______________;
A.CuSO4 B.Cu2(OH)2CO3 C.NaOH D.CuO
(5)“加热脱水”时,加入SOCl2的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定环境中,下列各组离子一定大量共存的是
A. 甲基橙呈红色的溶液中:K+、Na+、S2-、AlO2-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 常温下,在![]() = 1×1012的溶液中:NH4+、CO32-、K+、Cl-
= 1×1012的溶液中:NH4+、CO32-、K+、Cl-
D. 常温下,水电离出的c(OH—)=1×10—13 mol/L的溶液中:Na+、NH4+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com