
| A. | AlCl3,H2SO4,KOH | B. | BaCl2,NaOH,KHCO3 | ||
| C. | AgNO3,HNO3,NaBr | D. | FeCl3,HNO3,Ca(OH)2 |
分析 A、AlCl3,H2SO4,KOH混合,首先硫酸与氢氧化钾发生中和反应;
B、BaCl2,NaOH,KHCO3混合,首先NaOH和KHCO3发生反应生成碳酸根,碳酸根与BaCl2反应生成碳酸钡沉淀;
C、AgNO3,HNO3,NaBr混合,只有AgNO3与NaBr反应生成AgBr沉淀;
D、FeCl3,HNO3,Ca(OH)2混合即按照物质的量之比为1:1:1进行反应,首先HNO3和Ca(OH)2发生中和反应;
解答 解:A、AlCl3,H2SO4,KOH等物质的量浓度、等体积的溶液混合即按照物质的量之比为1:1:1进行反应,首先硫酸与氢氧化钾发生中和反应,硫酸过量与氯化铝不反应,所以无沉淀物产生,故A正确;
B、BaCl2,NaOH,KHCO3等物质的量浓度、等体积的溶液混合即按照物质的量之比为1:1:1进行反应,首先NaOH和KHCO3发生反应生成碳酸根,碳酸根与BaCl2反应生成碳酸钡沉淀,故B错误;
C、AgNO3,HNO3,NaBr等物质的量浓度、等体积的溶液混合即按照物质的量之比为1:1:1进行反应,只有AgNO3与NaBr反应生成AgBr沉淀,故C错误;D、FeCl3,HNO3,Ca(OH)2等物质的量浓度、等体积的溶液混合即按照物质的量之比为1:1:1进行反应,首先HNO3和Ca(OH)2发生中和反应,Ca(OH)2过量与FeCl3反应生成氢氧化铁沉淀,故D错误;
故选:A.
点评 本题主要考查了元素化合物的基本知识,关键熟悉物质之间的反应是解题的关键,难度不大.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒与三层滤纸 | |
| B. | 过滤操作中,漏斗径与烧杯内壁 | |
| C. | 往试管中添加液体时,试剂瓶口与试管口 | |
| D. | 用胶头滴管向试管滴液体时,滴管尖端与试管内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题




 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O. .
.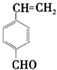 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3和Na2O2 | B. | 铝粉和NaOH | C. | Na2SO3和SO3 | D. | Na2CO3和P2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 | |
| B. | 反应 ①、②、③均是氧化还原反应 | |
| C. | 反应 ②配平后,H2O的化学计量数是5 | |
| D. | 整个反应过程中每有16.8g Fe参加反应转移0.8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3水解使溶液呈酸性,并能起净水作用,使水中悬浮的杂质沉降 | |
| B. | 浓度为5mol•L-1和0.5mol•L-1的两种FeCl3溶液,其它条件相同时,Fe3+离子的水解程度前者比后者低 | |
| C. | 加热FeCl3溶液并蒸干,再灼烧,此时得到的固体是无水氯化铁 | |
| D. | 为了抑制Fe3+的水解,更好地保存FeCl3溶液,应向其中加入少量的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com