
| A. | 正、逆反应速率相等均为零 | |
| B. | 反应物和生成物的浓度保持一定 | |
| C. | SO2、O2、SO3分子数目之比为2:1:2 | |
| D. | 单位时间内消耗a mol SO2,同时生成a mol SO3 |
分析 可逆反应2SO2(g)+O2 (g)?2SO3 (g)为气体体积缩小的反应,该反应达到平衡状态时,正反应速率与逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.达到平衡状态时,正逆反应速率相等,但不等于0,故A错误;
B.反应物和生成物的浓度保持一定,表明正逆反应速率相等,该反应达到平衡状态,故B正确;
C.SO2、O2、SO3分子数目之比为2:1:2,无法判断正逆反应速率是否相等,则无法判断平衡状态,故C错误;
D.单位时间内消耗a mol SO2,同时生成a mol SO3,表示的都是正反应速率,无法判断正逆反应速率是否相等,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意可逆反应达到平衡状态时正逆反应速率相等,但不等于0,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
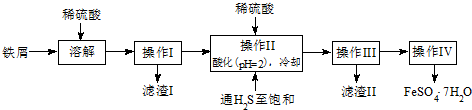
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和C10 H22 | B. | 1-己烯和环己烷 | C. | C2H4和1-丁烯 | D. | 乙二醇和丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | Z在化合物中呈+1价 | |
| C. | Y与W可形成离子化合物 | |
| D. | W的单质能在Y的单质中燃烧生成WY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X>R | |
| C. | Z的单质能与Y的某些化合物发生置换反应 | |
| D. | X、Y、Z氢化物的稳定性:XH3>H2Y>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
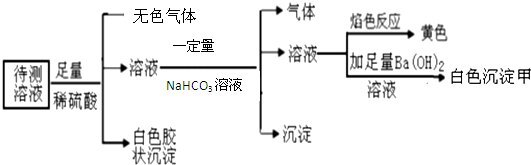
| A. | 一定含有Na+,可能存在K+ | |
| B. | 至少存在4种离子 | |
| C. | 无色气体是NO气体 | |
| D. | 白色沉淀甲中一定含有BaSO4和BaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com