
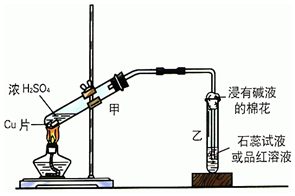
 实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.
分析 (1)二氧化硫检验漂白性,通常用品红溶液检验二氧化硫;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(3)反应中铜化合价0价变化为+2价,1mol铜失电子2mol,硫酸中硫元素化合价+6价变化为+4价,电子转移2mol;
(4)二氧化硫有毒,二氧化硫能够与碳酸钠溶液反应,则多余的二氧化硫可以用碳酸钠溶液吸收;
(5)二氧化硫具有还原性,能够使高锰酸钾溶液褪色.
解答 解:(1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,由于二氧化硫具有漂白性,能使得品红溶液褪色,故常用品红溶液验证二氧化硫的存在,即品红褪色,则证明有二氧化硫生成,
故答案为:品红溶液褪成无色;
(2)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)反应中铜化合价0价变化为+2价,1mol铜失电子2mol,硫酸中硫元素化合价+6价变化为+4价,电子转移2mol,单线桥标注反应的电子转移的方向和数目为: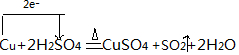 ,
,
故答案为: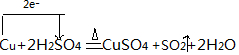 ;
;
(4)二氧化硫有一种有毒气体,二氧化硫能够与碳酸钠溶液反应,所以装置乙的试管口部放有一团浸有饱和碳酸钠溶液的棉花,可以吸收多余的二氧化硫,防止污染环境,
故答案为:吸收多余的SO2,防止污染环境;
(5)若把产生的SO2气体通入酸性KMnO4溶液中,看到的现象是高锰酸钾溶液褪色,说明SO2具有还原性,
故答案为:高锰酸钾溶液褪色;还原.
点评 本题考查了铜与浓硫酸的性质,题目难度中等,试题涉及铜与浓硫酸的反应、二氧化硫的性质及检验、性质实验方案的设计与评价等知识,注意明确二氧化硫与氯水的漂白原理的区别.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:推断题
 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤干馏制得煤焦油和焦炭 | |
| B. | 从海水中可以得到氯化镁,再加热分解可制金属镁 | |
| C. | 将石油裂解制得乙烯等化工原料 | |
| D. | 煤的气化主要反应是C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.
”,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,写出它的分子式C12H24,当它发生一氯取代物时,能生成2种沸点不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C5H6 | B. | 乙醇和二甲醚 | ||
| C. | 正丁烷和异戊烷 | D. | 一溴乙烷和二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com