
| ||
| 高温高压 |
| ||
| △ |
| 生成物平衡浓度系数次方的乘积 |
| 反应物平衡浓度系数次方的乘积 |
| ||
| △ |
| 1mol | ||
|
| 生成物平衡浓度系数次方的乘积 |
| 反应物平衡浓度系数次方的乘积 |


科目:高中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
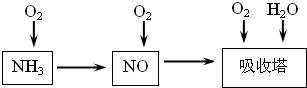
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
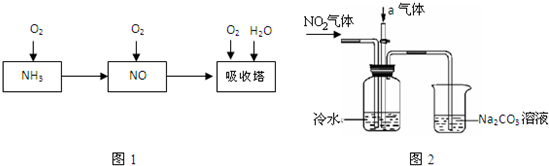
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2![]() 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.![]()
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:选择题
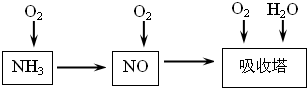
(14分)工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:

(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式 。当温度升高时,化学平衡常数K值 (填“增大”、“减小”、“无影响”)。
(2)硝酸厂尾气常用的处理方法是:催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol
H2O(1)=H2O(g) △H=+44.0 kJ/mol
则8g H2恰好将NO2转化成N2和H2O(1)时△H= 。
(3)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2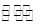 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是 (填字母)。
A.容器内N2、H2、NH3的浓度之比为l:3:2
B.
C.容器内压强保持不变
D.混合气体的密度保持不变
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.2 mol,n(H2)=1.2 mol, n(NH3)=0.8 mol,则反应速率v(N2)= ,平衡常数= (保留两位小数)。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡 (填向左、向右或不移动)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com