
| A、CH3COOH在常温下Ka数值约为l×101-2a |
| B、约有1.0×l0a-14 mol?L-1的水发生电离 |
| C、加热后溶液pH<a |
| D、加少量水后,溶液pH>a |
| c(CH3COOH)c(OH-) |
| c(CH3COO-) |
| c(CH3COOH)c(OH-) |
| c(CH3COO-) |
| c(H+) |
| c(H+) |
| Kw |
| Ka |
| Kw |
| Kh |
| 10-14 | ||
|
| 10-14 |
| 10-a |


科目:高中化学 来源: 题型:
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO ⑥ | ⑦SO2 ⑧Na2O | ⑨HCl ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

 +R′-Cl→
+R′-Cl→ +HCl
+HCl
| KOH |


查看答案和解析>>
科目:高中化学 来源: 题型:
A、电解氯化镁溶液:2Cl-+2H2O
| ||||
| B、将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO | ||||
| C、将少量CO2气体通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | ||||
| D、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| NaOH溶液 |
| CH3COOH |
| 浓硫酸,△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
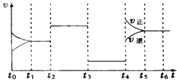 (1)已知下列反应:
(1)已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用装置制取少量H2: |
B、 用装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
C、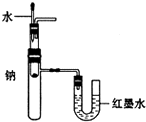 用装置验证Na和水反应的热效应 |
D、 用装置蒸干A1Cl3溶液制备无水AlC13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com