
下列离子方程式表达正确的是( )
A.SO2通入溴水中:SO2+2H2O+Br2===4H++SO +2Br-
+2Br-
-B.NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
C.漂白粉在空气中失效:ClO-+CO2+H2O===HClO+HCO
 D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液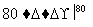 NaClO3溶液
NaClO3溶液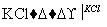 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
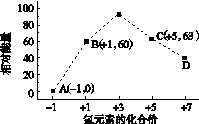
(4)一定条件下,在水溶液中1 mol Cl-、ClO (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.3g乙烷中所含的共价键数目为0.6×6.02×1023
B.含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023
C.相同条件下,1L CO和H2的混合气体完全燃烧消耗0.5L O2
D.相同物质的量OH-和CH3+含有相同数目的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
能在水溶液中大量共存的一组离子是( )
A.H+、I-、NO 、SiO
、SiO
B.Ag+、Fe3+、Cl-、SO
C.K+、SO 、Cu2+、NO
、Cu2+、NO
D.NH 、OH-、Cl-、HCO
、OH-、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
能大量共存于同一溶液中,且当溶液中加入过量的NaOH溶液或少量稀硫酸时,都能产生白色沉淀的离子组是( )
A.Ba2+、Mg2+、NO 、CO
、CO B.H+、Ba2+、Al3+、Cl-
B.H+、Ba2+、Al3+、Cl-
C.K+、Ba2+、Cl-、HCO D.NH
D.NH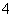 、Ba2+、Fe3+、Cl-
、Ba2+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某电镀铜厂有两种废水需要处理,一种废水中含有CN-,另一种废水中含有Cr2O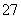 。该厂拟定如图所示的废水处理流程。
。该厂拟定如图所示的废水处理流程。
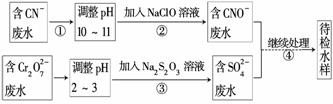
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是___ _____________________________________________________________________。
_____________________________________________________________________。
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因________________________________________________________________________。
(3)②中反应后无气体放出,该反应的离子方程式为
________________________________________________________________________。
(4)③中反应时,每0.4 mol Cr2O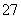 转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
转移2.4 mol e-,该反应的离子方程式为________________________________________________________________________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
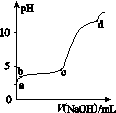
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水,生成B。B的结构简式为__________。B通入溴水能发生__________反应生成C,C的结构简式为__________。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________。
(3)写出下列反应的化学方程式:
①A―→B_____________________________________________;
②B―→C_____________________________________________;
③A―→D_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com