
 热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).分析 (1)化学反应过程中一定伴随着能量的变化,反应焓变主要是指反应前后的热量变化;依据能量守恒分析焓变,结合焓变计算:△H=H(终态)-H(始态),H确定反应吸热放热;△H<0为放热反应;△H>0为吸热反应;
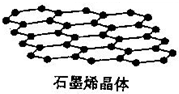
(2)石墨晶体结构如图,1mol碳形成1.5mol的碳碳键,所以C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;
(3)依据盖斯定律的含义,化学反应的△H便是定值,与反应的途径无关,结合热化学方程式计算得到;
解答 解:(1)化学反应过程中一定伴随着能量的变化,反应焓变主要是指反应前后的热量变化;对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D):△H=H(终态)-H(始态),判断可知△H<0;反应是放热反应;
故答案为:小于; 放热;
(2)石墨晶体结构如图,1mol碳形成1.5mol的碳碳键,所以C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;故答案为:C(s、石墨)+O2(g)═CO2(g);△H=+$(\frac{3}{2}a+b-2c)kJ•mo{l}^{-1}$;
(3)依据盖斯定律
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ•mol-1
①×3-③×2+②得到:6FeO(s)+6CO(g)═6Fe(s)+6CO2(g)△H=-66 kJ•mol-1
得到热化学方程式为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ•mol-1
故答案为:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ•mol-1
点评 本题考查了反应的能量变化,反应的焓变计算方法,焓变与物质焓的计算关系,盖斯定律的计算应用,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液(Ba(OH)2):用K2SO4溶液 | B. | NaCl溶液(Na2SO4):用Ba(NO3)2溶液 | ||
| C. | KOH溶液K2CO3:用CaCl2溶液 | D. | HNO3溶液(HCl):用AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用惰性电极电解熔融的MgO可制得Mg | |
| B. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| C. | 草木灰可与铵态氮肥混合施用 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH和CO2 | C. | AlCl3和NaOH | D. | Na2O2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
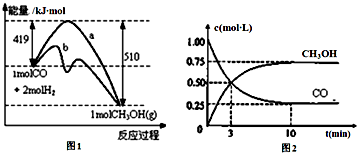 工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol
工业上用CO生产燃料甲醇.一定温度和容积条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com