
【题目】下列表述与示意图一致的是
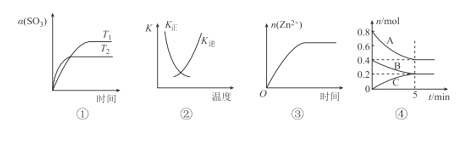
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
【答案】B
【解析】
A.由图①知T2时曲线的斜率大于T1时曲线的斜率,说明T2>T1,结合2SO3(g)=2SO2(g)+O2(g) △H>0,当温度越高,越利于正向移动,因而SO3的平衡转化率会变大,即T2时SO3的平衡转化率大于T1时SO3的平衡转化率,A项错误;
B.K正曲线与K逆曲线相交时,即K正=K逆,说明反应H2(g)+I2(g)=2HI(g)达到平衡状态,根据勒夏特列原理,结合△H<0,温度越高越利于逆向移动,此时K正<K逆,B项正确;
C.稀盐酸与过量锌粒反应为放热反应,一开始反应速率越来越快,但随着反应进行,盐酸浓度变小,反应速率越来越小,因而n(Zn2+)随时间的变化曲线斜率先越来越大,然后越来越小直至为0,C项错误;
D.由图④知5min反应达到平衡,又v(B)=![]() ,反应容器的体积不知道,无法计算从开始到平衡时B的平均反应速率,D项错误;
,反应容器的体积不知道,无法计算从开始到平衡时B的平均反应速率,D项错误;
故选B。


科目:高中化学 来源: 题型:
【题目】甲烷催化裂解、氧气部分氧化和水煤气重整是目前制氢的常用方法。回答下列问题:
(1)甲烷隔绝空气分解,部分反应如下:
Ⅰ.CH4(g)=C(s)+2H2(g) H1=+74.9kJ/mol
Ⅱ.6CH4(g)=C6H6(g)+9H2(g) H2=+531kJ/mol
Ⅲ.2CH4(g)=C2H4(g)+2H2(g) H3=+202kJ/mol
①反应I的△S___(填“>”或“<”)0。
②![]() 的 △H=______kJ/mol。
的 △H=______kJ/mol。
(2)CH4用水蒸气重整制氢包含的反应为:
Ⅰ.水蒸气重整:![]()
Ⅱ.水煤气变换:![]()
平衡时各物质的物质的量分数如图所示:
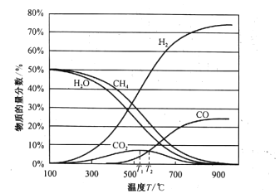
①为提高CH4的平衡转化率,除压强、温度外,还可采取的措施是___________(写一条)。
②温度高于T1℃时,CO2的物质的量分数开始减小,其原因是___________。
③T2℃时,容器中![]() ______________。
______________。
(3)甲烷部分氧化反应为![]() 。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
。已知甲烷部分氧化、甲烷水蒸气重整、水煤气变换反应的平衡常数的自然对数lnKp与温度的关系如图所示:
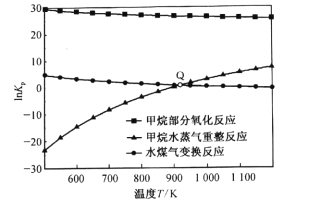
①图中Q点时,反应![]() 的InKp=________。
的InKp=________。
②在某恒压密闭容器中充入lmol CH4和1mol H2O(g)在某温度下发生水蒸气重整反应达到平衡时,CH4的转化率为50%,容器总压强为1 atm。H2的平衡分压p(H2)=____atm;此温度下反应的lnKp=___(已知;ln3≈l.1,ln4≈l.4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____。
(2)AsF3 分子的空间构型为_____,As 原子的杂化轨道类型为_____。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____,配原子为_____。
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________,阴离子的平均配位数与纯粹的 NiO 晶体相比____________(填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________示例:Fe3O4 写作 Fe2+Fe23+O4)。

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________并说明 a=__________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
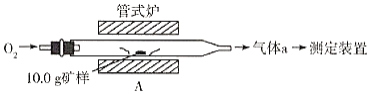
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH(OH)CH2CH3![]() CH3CH=CHCH3+H2O,下列有关说法不正确的是( )
CH3CH=CHCH3+H2O,下列有关说法不正确的是( )
A.CH3CH=CHCH3分子中所有碳原子处于同一平面
B.与CH3CH=CHCH3和Cl2的加成产物分子式相同的物质共有8种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与甘油互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.乙烷燃烧热的热化学方程式:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-2319.6 kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的溶解方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是
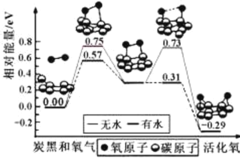
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
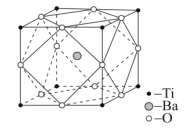
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为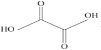 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com