
| A. | NA个氧分子和NA个氢分子的质量比等于8:1 | |
| B. | 11.2L H2中含有的原子数为NA个 | |
| C. | 54g H2O中含有分子数为3NA个 | |
| D. | 1mol/L Na2SO4溶液中SO42-离子数为NA个 |
分析 A.NA个氧分子和NA个氢分子的物质的量都为0.5mol,根据m=nM计算出二者质量比;
B.气体状况未知,Vm不确定;
C.依据n=$\frac{m}{M}$计算水分子的物质的量,依据N=nNA计算其个数;
D.溶液体积未知.
解答 解:A.氧气和氢气都为双原子分子,NA个氧分子和NA个氢分子的物质的量都为0.5mol,根据m=nM可知,二者质量比就等于其摩尔质量之比,即质量比为:32g/mol:2g/mol=16:1,故A错误;
B.气体状况未知,Vm不确定,无法计算11.2L H2的物质的量,故B错误;
C.54g水的物质的量为3mol,3mol水中含有分子数为3NA个,故C正确;
D.溶液体积未知,无法计算硫酸根离子个数,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量之间的转化是解题关键,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 由长、短周期元素共同组成的元素族称为主族 (除零族外) | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 互为同位素的不同核素,物理性质和化学性质都不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 | |
| C. | 温度越高反应速率越快,平衡时生成的SO3越多 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素L、Z、W的单质晶体属于同种类型的晶体 | |
| B. | 由于W、Z、Q元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| C. | A、Q两种元素能形成A2Q和A2Q2型化合物 | |
| D. | 元素W和Q的某些单质不可以作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
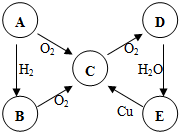 ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式)
ABCDE五种物质中含有同一种元素,其相互转化关系如图所示.如果A是淡黄色固体:(以下均写化学式) B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
B→C的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
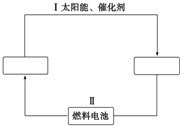 氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用.请在下图的两个空框中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).从能量转换的角度看,过程Ⅱ主要是( )| A. | 氢能转化为化学能 | B. | 化学能转化为电能 | ||
| C. | 太阳能转化为热能 | D. | 电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C可用于治疗胃酸过多 | |
| B. | 加入Na2S可消除污水中的污染Hg2+ | |
| C. | 利用太阳能等清洁能源有利于保护环境 | |
| D. | 开发废电池的综合利用技术有利于防止污染土壤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| C. | 原子序数:b>a>c>d | |
| D. | 金属性:B>A,气态氢化物稳定性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com