
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
科目:高中化学 来源:2015-2016学年河北省邯郸市高一5月月考化学试卷(解析版) 题型:推断题
下表是A、B两种有机物的有关信息:
A | B |
①能使溴的四氯化碳溶液褪色; ②比例模型: ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________。
(2)A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号)
a.无色无味液体
b.有毒
c.不溶于水
d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色
f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:填空题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
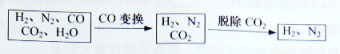
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O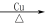 CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。

①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:选择题
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是
A.碳酸钙粉末 B.稀硫酸 C.氯化钙溶液 D.二氧化硫水溶液
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(上海卷参考版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是
A.海带提碘 B.氯碱工业
C.氨碱法制碱 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(选考)(解析版) 题型:选择题
如图所示的A、B两个电解池中的电极均为铂,在A池中加入足量0.05 mol·L-1的CuCl2溶液,B池中加入足量0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )
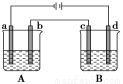
A.2∶2∶4∶1 B.1∶1∶2∶1
C.2∶1∶1∶1 D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(选考)(解析版) 题型:选择题
一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体总物质的量 ④B物质的量浓度.
A.①④ B.只有②③ C.②③④ D.只有④
查看答案和解析>>
科目:高中化学 来源:2015-2016年浙江宁波效实中学高一下期中化学卷(创)(解析版) 题型:填空题
HA、H2B、H3C分别表示一元、二元、三元弱酸,它们之间有如下反应:
①HA+ HC2-(少量)= A-+H2 C- ② H2B(少量)+2A- =B2-+ 2HA ③ H2B(少量)+ H2 C-= HB-+ H3C
(1)25℃时,Cmol/L的HA溶液的pH=a,则电离常数K= 电离度а= (精确计算,列出计算式即可)
(2)在相同温度和浓度条件下,HA、H2B、H3C三种酸的电离常数K1、K2、K3(H2B、H3 C指一级电离常数)的大小关系是:
(3)完成下列反应的化学方程式或离子方程式.HA(过量)+ C3- .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江杭州二中高一下期中化学试卷(解析版) 题型:选择题
实验室用蓄电池电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极:Pb+SO42-= PbSO4+2e- 正极:PbO2+4H++SO42-+2e-= PbSO4+2H2O,今若制得0.05 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com