
+ 4 |
2- 3 |
2- 4 |
| 11.65g |
| 233g/mol |
| 11.65g |
| 233g/mol |


科目:高中化学 来源: 题型:
| A、1molNa2O和Na2O2的混合物中含有的阴、阳离子总数是3NA |
| B、常温下,1L0.1 mol?L-1的NH4NO3溶液中含有的氮原子数为0.2NA |
| C、46g有机物C2H6O中含有的H-O键的数目为NA |
| D、标准状况下,将0.1molCl2通入足量NaOH溶液中,反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
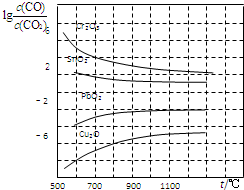 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.| 50-80℃ |
| 180-200℃ |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
| c(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1s22s22p63s23p63d74s2 |
| B、1s22s22p63s23p63d54s1 |
| C、1s22s22p63s23p63d104s24p1 |
| D、1s22s22p63s23p64s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
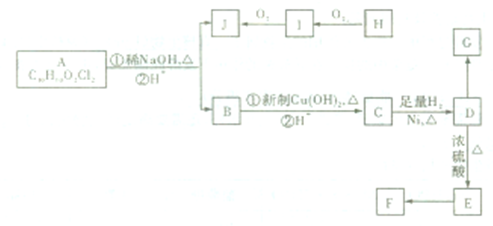
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com