
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
(1)Al>Mg>Na 元素Mg价电子排布式为3s2,处于全充满状态,比Al价电子排布(3s23p1)稳定,则Mg的第一电离能大于Al的第一电离能
(2)①C<O<N ②极性 非极性 ③氨分子间存在氢键,分子间作用力大,因而易液化 ④四面体形 V形 ⑤1∶1
(3)①b ②+6 ③1s22s22p63s23p63d9或[Ar]3d9
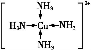
【解析】(1)X、Y、Z为第三周期元素,根据其原子的第一至第四电离能知,X、Y、Z分别为Al、Mg、Na,X、Y、Z的电负性从大到小的顺序为Al>Mg>Na,元素Mg价电子排布式为3s2,处于全充满状态,比Al价电子排布稳定,则Mg的第一电离能大于Al的第一电离能。(2)根据题给信息知,A、B、C、D分别为碳、氮、氧、氢。①由于N元素的p电子满足洪特规则特例,能量降低,第一电离能升高,故N元素的第一电离能比氧元素的第一电离能大,则C、N、O的第一电离能由小到大的顺序为:C<O<N;②M为甲烷,甲烷含有碳氢极性共价键,分子构型为正四面体形,故甲烷为非极性分子;③N为氨,是一种易液化的气体,是因为氨分子间存在氢键,分子间作用力大,因而易液化;④W为水,中心原子氧原子上有两对孤电子对,跟中心原子周围的σ键加起来是4,它们相互排斥,形成四面体,故水分子的VSEPR模型的空间构型为四面体形,水分子的空间构型为V形;⑤CN-和N2分子中的π键数目比为2∶2=1∶1。(3)E、F、G分别为钾、铬、铜。①钾为体心立方堆积;②铬元素的价电子排布式为3d54s1,故其化合物中最高化合价为+6;③基态Cu的核外电子排布式为[Ar]3d104s1,故C 的核外电子排布式为[Ar]3d9,C
的核外电子排布式为[Ar]3d9,C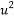 和NH3分子形成的配离子为[Cu(NH3)4
和NH3分子形成的配离子为[Cu(NH3)4 ,其结构式为
,其结构式为 。
。


科目:高中化学 来源:2014高考化学名师选择题专练 有机物组成练习卷(解析版) 题型:选择题
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列有关该物质的说法不正确的是( )
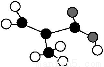
A.该物质的分子式为C4H6O2
B.该物质能发生加成反应、取代反应和氧化反应
C.该物质的最简单的同系物的结构简式为CH2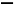 CHCOOH
CHCOOH
D.该物质是石油分馏的一种产物
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.“海沙危楼”是由于海沙带有腐蚀性,会腐蚀混凝土中的钢筋等
B.食用地沟油对人体危害极大,是因为含有黄曲霉素等有毒物质
C.开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D.光化学烟雾、温室效应、硝酸型酸雨的形成都只与氮氧化物有关
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.5 mol O3与11.2 L O2所含的分子数一定相等
B.常温常压下,78 g Na2O2和Na2S的混合物中含有的阴离子数为NA
C.2SO2(g)+O2(g)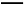 2SO3(g)和SO2(g)+
2SO3(g)和SO2(g)+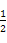 O2(g)
O2(g)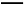 SO3(g)的ΔH相等
SO3(g)的ΔH相等
D.物质的量浓度为0.25 mol/L的MgCl2溶液中,含有Cl-个数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 NA的应用练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.在0 ℃时,22.4 L氢气中含有2NA个氢原子
B.电解食盐水若产生2 g氢气,则转移的电子数目为NA
C.1 mol乙烷分子中共价键总数为7NA
D.密闭容器中46 g NO2含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2p轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为 形;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B C(填“大于”或“小于”);A、C两元素可组成原子个数比为1∶1 的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为 ;F单质形成的晶体类型为 。
(4)F元素氧化物的熔点比其硫化物的 (填“高”或“低”),请解释其原因
。
(5)E元素与C元素形成的化合物是 化合物,其晶体熔化时破坏的作用力是 ,晶体EC的熔点比晶体BC2的熔点 (填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
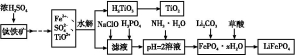
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O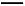 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
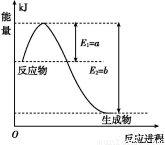
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度
C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题:黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题8化学反应速率与化学平衡练习卷(解析版) 题型:填空题
一定温度下2 L的恒容容器甲中,加入2 mol碳和2 mol CO2发生如下反应: C(s)+CO2(g)  2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
2CO(g) ΔH>0,测得容器中CO2的物质的量随时间t的变化关系如图所示。
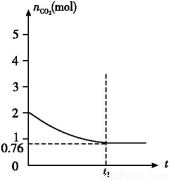
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数 (结果保留一位小数)。
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填“增大”、“减小”、“不变”或“无法确定”)。
(4)相同温度下,2 L的恒容容器乙中加入4 mol碳和4 mol CO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
(5)相同温度下,2 L的恒容容器丙中加入4 mol碳、4 mol CO2和4 mol CO。开始反应时v正 v逆(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com