
【题目】全世界每年因钢铁锈蚀造成大量的损失。某城市拟用如图方法保护埋在弱碱性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法正确的是( )
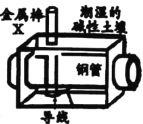
A.钢管附近土壤的pH小于金属棒附近土壤
B.钢管上的电极反应式为:O2+2H2O+4e-=4OH-
C.金属棒X的材料应该是比镁活泼的金属
D.也可以外接直流电源保护钢管,直流电源正极连接金属棒X
科目:高中化学 来源: 题型:
【题目】如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于_____腐蚀。
(2)若试管内液面上升,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:________。
(3)若试管内液面下降,则原溶液是_____性,发生______腐蚀,电极反应:负极:_______,正极:______________。
(4)若溶液甲为水,溶液乙为海水,则铁钉在____(填“甲”或“乙”)溶液中腐蚀的速度快。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是
![]()
A.W、X对应的简单离子的半径:X>W
B.Y元素在周期表中的位置为二周期第IVA族
C.将W的氯化物的水溶液加热蒸干并灼烧可得到W的氧化物
D.该漂白剂结构中,Y、X原子的最外层均满足8电子结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人剧烈运动后肌肉发酸是因为当体内氧气缺少时葡萄糖发生反应产生了乳酸,其结构简式为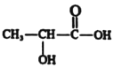 。下列关于乳酸的说法正确的是( )
。下列关于乳酸的说法正确的是( )
A.乳酸的系统命名为1-羟基丙酸
B.与乳酸具有相同官能团的所有同分异构体(包括乳酸)共3种
C.乳酸既可发生取代反应、消去反应又可发生加成反应
D.乳酸发生缩聚反应的方程式为n +nH2O
+nH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示装置时行实验:
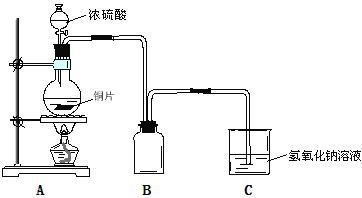

(1)B是用来收集实验中产生的气体的装置,装置图补充完整后正确的是__________;

(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:_____________________________________。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是___________(填写字母编号)。
A.硫酸钠溶液 | B.BaCl2溶液 | C.银粉 | D.Na2CO3溶液 |
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为原因是__________________________。
(3)为了确定反应生成的主要气体成分,还可以在实验装置A和B之间补充以上右图D装置,其中洗气瓶中可以盛有__________(试剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素C、N、O、K的电负性从大到小依次为______。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为______。
(3)下图是周期表中短周期的一部分,A的单质是空气中含量最多的物质,其中第一电离能最小的元素是______(填“A”“B”“C”或“D”)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料。基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN中B元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式:
(1)CaCl2:___;Na2S:___;HCl:___。
写出下列物质的结构式:
(2)HClO:___;CO2:___;N2:___。
写出下列物质的结构示意图:
(3)Ca:___;Mg2+:___;F-:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com