
【题目】龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I.已知龙胆酸甲酯结构如图所示:

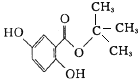
(1)龙胆酸甲酯的官能团名称为 。
(2)下列有关龙胆酸甲酯的描述,不正确的是 (填字母)。
A.难溶于水
B.不能发生消去反应
C.能与溴水反应
D.遇FeCl3溶液能显红色
E.能与碳酸氢钠溶液反应产生二氧化碳
(3)1摩尔龙胆酸甲酯与足量的NaOH溶液反应,最多消耗NaOH mol 。
II.已知X及其他几种有机物存在如下转化关系,且测得A中含三个甲基:

说明:不对称烯烃与卤化氢发生加成反应主要产物遵循以下规则马氏规则:通常情况下,氢加到含氢多的不饱和碳原子一侧反马氏规则:在过氧化物作用下,卤原子加到含氢多的不饱和碳原子一侧
回答以下问题:
(4)X的结构简式为 。
(5)B的系统命名是___________________________ 。
(6)写出C生成D的化学方程式 (用结构简式表示)。
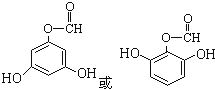
(7)写出满足下列条件的龙胆酸的一种同分异构体的结构简式 。
①能发生银镜反应
②能使FeCl3溶液显色
③酯类
④苯环上的一氯代物只有两种
【答案】(1)羟基 酯基(2分)(2)DE(2分) (3)3mol (2分)
(4)  (2分)(5)2-甲基-1-丙醇(2分)
(2分)(5)2-甲基-1-丙醇(2分)
(6)(CH3)2CHCHO+2Ag(NH3)2OH![]() H2O +2Ag↓+3NH3+(CH3)2CHCOONH4(3分)
H2O +2Ag↓+3NH3+(CH3)2CHCOONH4(3分)
(7)
【解析】
试题分析:I.(1)根据龙胆酸甲酯的结构简式可知,分子含有的含氧官能团名称为羟基、酯基。
(2)A、分子中含有酯基,因此难溶于水,A正确;B、由龙胆酸甲酯的结构可知,分子中含有酚羟基,没有醇羟基,不能发生消去反应,B正确;C、由龙胆酸甲酯的结构可知,分子中含有酚羟基,具有酚的性质,酚羟基的邻位有H原子,能与溴水反应,C正确;D、含有酚羟基,能与氯化铁发生显色反应,显紫色,D错误;E、由龙胆酸甲酯的结构可知,分子中含有酚羟基,酚羟基的酸性小于碳酸,与碳酸氢钠溶液不反应E错误,答案选DE。
(3)龙胆酸甲酯与足量氢氧化钠溶液发生水解反应,同时发生酚与氢氧化钠的中和反应,因此1摩尔龙胆酸甲酯与足量的NaOH溶液反应,最多消耗NaOH3mol。
II.X在稀硫酸、加热条件下生成龙胆酸与A,为酯的水解反应,A为醇。A发生消去反应生成C4H8,C4H8是丁烯,再双氧水的作用下与溴化氢发生反应生成C4H9Br。C4H9Br是卤代烃,发生消去反应生成B,所以A与B互为同分异构体,B能催化氧化生成C,C能发生银镜反应,故B中-OH连接的碳原子上含有2个H原子,则B的结构简式为(CH3)2CHCH2OH或CH3CH2CH2CH2OH,对应的A为(CH3)3COH或CH3CH2CH(OH)CH3,对应C为(CH3)2CHCHO或CH3CH2CH2CHO,C发生银镜反应生成D。由于A中含三个甲基,所以A、B、C的结构简式分别是(CH3)3COH、(CH3)2CHCH2OH、(CH3)2CHCHO。
(4)X水解生成A和龙胆酸,则根据二者的结构简式可知,X的结构简式为 。
。
(5)B的结构简式为(CH3)2CHCH2OH,系统命名是2-甲基-1-丙醇;
(6)C中含有醛基,可以发生的银镜反应生成D,则C→D的化学反应方程式为(CH3)2CHCHO+2Ag(NH3)2OH![]() H2O +2Ag↓+3NH3+(CH3)2CHCOONH4。
H2O +2Ag↓+3NH3+(CH3)2CHCOONH4。
(7)①能发生银镜反应,说明含有醛基;②能使FeCl3溶液显色,说明含有酚羟基;③酯类,说明含有酯基;④苯环上的一氯代物只有两种,说明结构苯环上的取代基对称,则可能的结构简式为 。
。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】电解法制取有广泛用途的Na2FeO4,同时获得氢气。工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2。
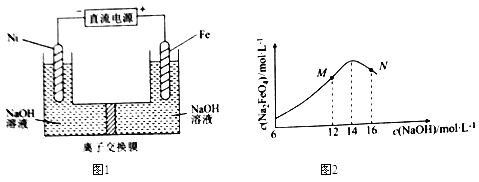
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )
A.制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O
B.电解过程中,须将阴极产生的气体及时排出
C.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
D.图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置制取乙酸乙酯,请回答以下问题。
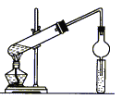
(1)导气管连接球形干燥管插入Na2CO3溶液中,除了冷凝作用外,另一个重要作 ;
(2)浓H2SO4的作用是 ;
(3)饱和Na2CO3溶液的作用除了降低乙酸乙酯的溶解度和除去乙醇外,还有_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是___________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物种类繁多的原因,不正确的是( )
A.碳原子有四个价电子 B.碳原子彼此可结合成长链
C.组成有机物的元素种类很多 D.有机物容易形成同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

(1)乙容器中,平衡后物质A的转化率为________
(2)x=________
(3)T ℃时该反应的平衡常数为________
(4)下列说法中正确的是
A.向平衡后的乙容器中充入氦气可使重新达到平衡时的c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中A的浓度范围为0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
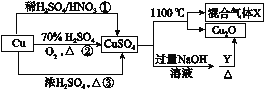
A.途径①所用的混酸中H2SO4与HNO3的物质的量之比最好为3∶2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1 mol CuSO4在1100 ℃所得混合气体X中O2一定为0.75 mol
D.Y可以是葡萄糖溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是
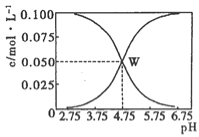
A.由题给图示可求出25℃时醋酸的电离平衡常 数Ka=10-4.75
B.W点所表示的溶液中:c(Na+)+c(H+) =c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05mol HCl气体(溶液体积变化可忽略):c(H+) = c(CH3COOH) + c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com