
向CuS04溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人S02气体,溶液逐渐变成无色。下列分析正确的是
| A.滴加KI溶液时,转移2 mol e一时生成1 mol白色沉淀 |
| B.通入S02后溶液逐渐变成无色,体现了S02的漂白性 |
| C.通入S02时,S02与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>S02 |
D
解析试题分析:由题意可知,向CuS04溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色,说明Cu2+氧化I-离子为I2自身被还原成CuI,再通入S02气体,溶液逐渐变成无色,说明I2氧化二氧化硫,自身被还原成I-离子。A、根据得失电子守恒,滴加KI溶液时,转移2 mol e一时生成2 mol白色沉淀,错误;B、通入S02后溶液逐渐变成无色,体现了S02的还原性,错误;C、通入S02时,S02与I2反应,I2作氧化剂,错误;D、根据实验事实,物质的氧化性:Cu2+>I2>S02,正确,答案选D。
考点:考查对实验现象的分析能力,物质的氧化性的判断,氧化还原反应的计算


科目:高中化学 来源: 题型:单选题
下列事实不能说明元素的金属性或非金属性相对强弱的是
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
| D | t℃时,Br2 + H2 2HBr K = 5.6×107 2HBr K = 5.6×107I2 + H2  2HCl K = 43 2HCl K = 43 | 非金属性:Br > I |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,RO3n-与R2-发生如下反应:RO3n-+2 R2—+ 6H+ ="3R" + 3H2O,下列关于元素R的叙述中正确的是( )
| A.R原子的最外层上有4个电子 |
| B.RO3n-中的R只能被还原 |
| C.HnRO3一定是强酸 |
| D.R的单质既具有氧化性又具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是
| A.C+HNO3 | B.SO2+HNO3 | C.Fe(OH)3+HNO3 | D.FeO+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+=Fe3++Ce3+
Sn2++2Fe3+=2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700 mL,放出2.24 L NO气体(标准状况)。则该铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
| A.(a+3b) mol |
B.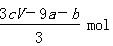 |
C.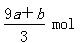 |
| D.(cV-3a-9b) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用高铁酸钠(Na2FeO4)对河(湖)水消毒是城市饮水处理的新技术。已知反应
Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。下列说法中不正确的是( )。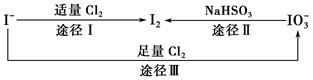
| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com