


 )的说法正确的是AD.
)的说法正确的是AD.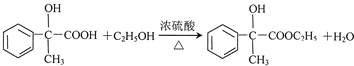 .
.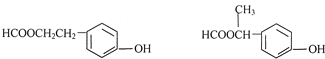 .
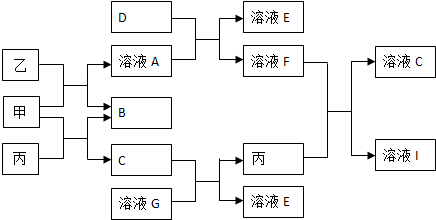
.分析 反应①、反应②、反应⑤的原子利用率均为100%,属于加成反应,结合反应②的产物,可知烃A为HC≡CH,B为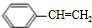 ,而G的相对分子质量为78,则G为
,而G的相对分子质量为78,则G为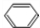 .C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为
.C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为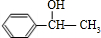 ,D为
,D为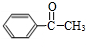 ,E为
,E为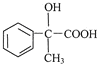 ,F为
,F为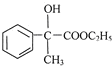 ,F在浓硫酸、加热条件下发生消去反应得到X.乙醛与HCN发生加成反应、酸性条件下水解得到
,F在浓硫酸、加热条件下发生消去反应得到X.乙醛与HCN发生加成反应、酸性条件下水解得到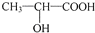 ,与甲醇反应酯化反应生成
,与甲醇反应酯化反应生成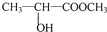 ,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到
,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到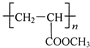 .
.
解答 解:反应①、反应②、反应⑤的原子利用率均为100%,属于加成反应,结合反应②的产物,可知烃A为HC≡CH,B为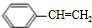 ,而G的相对分子质量为78,则G为
,而G的相对分子质量为78,则G为 .C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为
.C可以发出催化氧化生成D,D发生信息中I的反应,则反应③为卤代烃在氢氧化钠水溶液、加热条件下发生的水解反应,则C为 ,D为
,D为 ,E为
,E为 ,F为
,F为 ,F在浓硫酸、加热条件下发生消去反应得到X.
,F在浓硫酸、加热条件下发生消去反应得到X.
(1)B为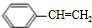 ,名称为苯乙烯,故答案为:苯乙烯;
,名称为苯乙烯,故答案为:苯乙烯;
(2)X中的含氧官能团名称为酯基,反应③的条件为:氢氧化钠水溶液、加热,反应③的反应类型是取代反应,
故答案为:酯基;氢氧化钠水溶液、加热;取代反应;
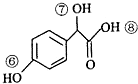
(3)关于药物Y( ),
),
A.药物Y的分子式为C8H804,含有酚羟基,遇氯化铁溶液可以发生显色反应,故A正确;
B.苯环与氢气发生加成反应,1mol药物Y与3molH2加成,Y中酚羟基的邻位能与浓溴水发生取代反应,1molY消耗2molBr2,故B错误;
C.羟基、羧基能与钠反应生成氢气,1mol药物Y与足量的钠反应可以生成1.5mol氢气,标况下氢气体积为33.6L,但氢气不一定处于标况下,故C错误;
D.羧基酸性最强,酚羟基酸性很弱,醇羟基表现为中性,药物Y中⑥、⑦、⑧三处-OH的电离程度由大到小的顺序是⑧>⑥>⑦,故D正确.
故选:AD;
(4)反应E-F的化学方程式: ,
,
故答案为: ;
;
(5)E( )同分异构体的符合下列条件:①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有:
)同分异构体的符合下列条件:①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应,含有甲酸形成的酯基,符合条件的同分异构体有: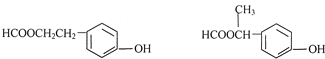 ,
,
故答案为: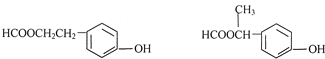 ;
;
(6)乙醛与HCN发生加成反应、酸性条件下水解得到 ,与甲醇反应酯化反应生成
,与甲醇反应酯化反应生成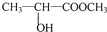 ,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到
,在浓硫酸、加热条件下发生消去反应生成CH2=CHCOOCH3,最后发生加聚反应得到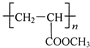 ,合成路线流程图为:
,合成路线流程图为: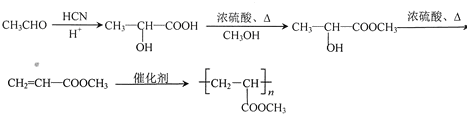 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用转化中有机物的结构与反应条件进行推断,熟练掌握官能团的性质与转化,较好的考查学生分析推理能力、知识迁移运用能力,难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
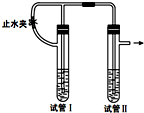 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
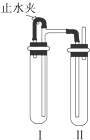 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
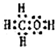 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(OH)2悬浊液检验乙醛:向10ml10%的硫酸铜溶液中加的2%NaOH溶液4-6滴,振荡后加入乙醛溶液0.5ml,加热 | |
| B. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| C. | 向盛有过量苯酚浓溶液的试管里逐滴加入稀溴水,边加边振荡,观察三溴苯酚的生成 | |
| D. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机层的水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com