
 ;
;分析 元素X、Y、Z、E、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,可推知Y为O元素;M元素与Y元素能形成化合物MY2和化合物MY3,化合物MY2中两种元素质量分数相同,则M为S元素;N-、Z+、X+的半径逐渐减小,可知X、Z处于ⅠA族,N处于ⅦA族,结合原子序数可知,Z为Na、N为Cl,化合物XN在常温下为气体,则X为H元素;E、Z、N的最高价氧化物的水化物两两能反应,应是氢氧化铝与强酸、强碱反应,故E为Al,
(1)Z最高价氧化物的水化物为NaOH,由钠离子与氢氧根离子构成;
(2)发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,
①恒温恒容下,甲容器通入1mol SO2和1mol O2单质,乙容器通入1molSO 3和0.5mol O2单质,二者得到相同的平衡状态,平衡时,甲中SO2的转化率与乙中SO3的分解率之和为1,但甲、乙起始反应温度相同,两容器均和外界无热量交换,甲中为温度升高,乙中温度降低,乙中所到达的平衡可以等效为在甲平衡的基础上降低温度,三氧化硫的分解率比与甲中等温度到达平衡的分解率低,据此判断;
②当可逆反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不再发生变化,由此衍生的一些物理量不变,注意选择的物理量应由变化到不再变化,说明到达平衡;
(3)2.7克Al的物质的量为0.1mol,100ml 2mol/L NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,二者发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知0.1molAl完全反应消耗0.1molNaOH,故剩余0.1molNaOH,生成0.1molNaAlO2,向反应后的溶液中滴入2mol/L HCl的溶液,当溶液中产生3.9克沉淀为氢氧化铝的质量,若溶液中Al元素全部转化为氢氧化铝,则氢氧化铝的质量=0.1mol×78g/mol=7.8g>3.9g,故Al元素没有全部沉淀,有两种情况:一是盐酸不足,只有部分偏铝酸钠转化氢氧化铝沉淀,二是盐酸过量,偏铝酸钠完全转化为氢氧化铝沉淀后,部分氢氧化铝溶解,结合方程式计算.
解答 解:Ⅰ.元素X、Y、Z、E、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,可推知Y为O元素;M元素与Y元素能形成化合物MY2和化合物MY3,化合物MY2中两种元素质量分数相同,则M为S元素;N-、Z+、X+的半径逐渐减小,可知X、Z处于ⅠA族,N处于ⅦA族,结合原子序数可知,Z为Na、N为Cl,化合物XN在常温下为气体,则X为H元素;E、Z、N的最高价氧化物的水化物两两能反应,应是氢氧化铝与强酸、强碱反应,故E为Al,
(1)Z最高价氧化物的水化物为NaOH,由钠离子与氢氧根离子构成,其电子式为: ,
,
故答案为: ;
;
(2)发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,
①恒温恒容下,甲容器通入1mol SO2和1mol O2单质,乙容器通入1molSO 3和0.5mol O2单质,二者得到相同的平衡状态,平衡时,甲中SO2的转化率与乙中SO3的分解率之和为1,但甲、乙起始反应温度相同,两容器均和外界无热量交换,甲中为温度升高,乙中温度降低,乙中所到达的平衡可以等效为在甲平衡的基础上降低温度,三氧化硫的分解率比与甲中等温度到达平衡的分解率低,若平衡时,甲中MY2的转化率为a,乙中MY3的分解率为b,则:a+b<1,
故答案为:<;
②A.v正(Y2)=2v逆(MY3),速率之比不等于化学计量数之比,反应为到达平衡,故A错误;
B.恒容条件下,混合气体的密度始终不变,故B错误;
C.平衡时二氧化硫与三氧化硫的浓度与转化率有关,平衡时二者浓度不一定相等,故C错误;
D.随反应进行总物质的量减小,混合气体的总物质的量不变,说明到达平衡,故D正确;
E.绝热条件下,甲容器内温度升高,容器内温度不变,说明到达平衡,故E正确;
F.SO2和O2的起始物质的量之比不等于化学计量数之比,二者质量比随反应进行发生变化,故二者质量比不变,说明到达平衡状态,故F正确,
故答案为:DEF;
(3)2.7克Al的物质的量为0.1mol,100ml 2mol/L NaOH溶液中n(NaOH)=0.1L×2mol/L=0.2mol,二者发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知0.1molAl完全反应消耗0.1molNaOH,故剩余0.1molNaOH,生成0.1molNaAlO2,向反应后的溶液中滴入2mol/L HCl的溶液,当溶液中产生3.9克沉淀为氢氧化铝的质量,若溶液中Al元素全部转化为氢氧化铝,则氢氧化铝的质量=0.1mol×78g/mol=7.8g>3.9g,故Al元素没有全部沉淀,有两种情况:一是盐酸不足,只有部分偏铝酸钠转化氢氧化铝沉淀,二是盐酸过量,偏铝酸钠完全转化为氢氧化铝沉淀后,部分氢氧化铝溶解,
3.9g氢氧化铝的物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,
①盐酸不足,只有部分偏铝酸钠转化氢氧化铝沉淀,则:
NaOH+HCl=NaCl+H2O
0.1mol 0.1mol
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl,
0.05mol 0.05mol
故HCl总物质的量=0.1mol+0.05mol=0.15mol,消耗盐酸的体积=$\frac{0.15mol}{2mol/L}$=0.075L=75mL;
②盐酸过量,偏铝酸钠完全转化为氢氧化铝沉淀后,部分氢氧化铝溶解,则:
NaOH+HCl=NaCl+H2O
0.1mol 0.1mol
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl,
0.1mol 0.1mol 0.1mol
Al(OH)3 +3HCl=AlCl3 +3H2O
(0.1-0.05)mol 3×(0.1-0.05)mol
故HCl总物质的量=0.1mol+0.1mol+3×(0.1-0.05)mol=0.35mol,消耗盐酸的体积=$\frac{0.35mol}{2mol/L}$=0.175L=175mL,
故答案为:75或175.
点评 本题综合较强,涉及结构性质位置关系应用、化学平衡、化学方程式计算,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将某有机物与溴的四氯化碳 溶液混合 | 溶液褪色 | 该有机物中必定含有 碳碳双键 |
| B | 向亚硫酸钠溶液中滴加硝酸 钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液己变质 |
| C | 向酸性高锰酸钾溶液中滴加 双氧水 | 紫色褪去,产生气泡 | H202具有还原性 |
| D | 向油脂皂化反应后的溶液中 滴入酚酞 | 溶液不变红 | 油脂己经完全皂化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
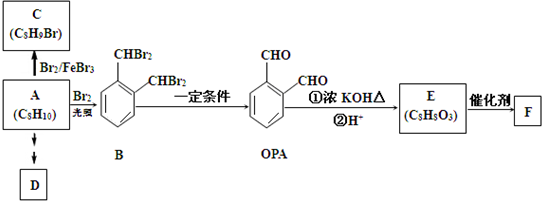

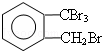 ;
; ;
; .
.
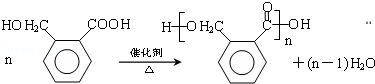 .
.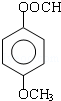 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
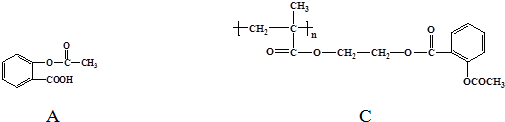
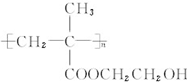 .
. 和CH3COOH(写结构简式).
和CH3COOH(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+、Fe3+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH- |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2含有的氧原子数目为NA | |
| B. | 常温常压下,22.4L CO2含有的分子数目为NA | |
| C. | lmolNa与氧气完全反应生成Na2O2时失去的电子数目为NA | |
| D. | 1mol/L K2CO3溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
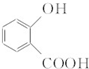
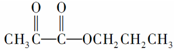 ,最简便的流程需要下列反应的顺序是
,最简便的流程需要下列反应的顺序是| A. | b d f g h | B. | e a d c h | C. | b a e c h | D. | e d c a h |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com