
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
|
| A. | 未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
|
| B. | 电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
|
| C. | 未通电前K+向铁极移动,通电后K+还向铁极移动 |
|
| D. | 镀锌层破损后对铁制品失去保护作用 |
考点:
电解原理.
专题:
电化学专题.
分析:
A、根据Zn的金属性强于Fe,未通电前上述镀锌装置可构成原电池,电镀时,镀件铁是阴极,和电源的负极相连,镀层金属锌是阳极,和电源的正极相连;
B、电镀时,每转移1mol电子析出0.5molZn,
C、原电池中,阳离子移向正极,电解池中,阳离子移向阴极;
D、镀锌铁制品的镀层破损后,易形成Zn﹣Fe原电池,Zn作负极优先被腐蚀,铁制品仍能受到保护.
解答:
解:A、未通电前上述镀锌装置可构成原电池,较活泼金属锌是负极,电镀时,镀件铁是阴极,和电源的负极相连,镀层金属锌是阳极,和电源的正极相连,故A错误;
B、电镀时,在阴极上Zn2++2e﹣=Zn,每转移1mol电子析出0.5molZn,故B正确;
C、未通电前的原电池中,阳离子移向正极,即K+向铁极移动,通电后的电解池中,阳离子移向阴极,即K+还向铁极移动,故C正确;
D、镀锌层破损后,能形成锌铁原电池,铁为正极,锌为负极,同样起到保护铁的作用,故D错误.
故选BC.
点评:
此题考查了原电池与电解池的工作原理及应用,解答本题时应明确电池或电解工作原理,对于其应用也要掌握,难度不大.


科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是()
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
①中实验②中现象()
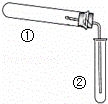
A. 铁粉与水蒸气加热 肥皂水冒泡
B. 加热NH4Cl和Ca(OH)2混合物 酚酞溶液变红
C. NaHCO3固体受热分解 澄清石灰水变浑浊
D. 石蜡油在碎瓷片上受热分解 Br2的CCl4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
多硫化钙[CaSx( x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得.不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙.
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
(1)硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x=4.
(2)取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解.原理如下:Sx2﹣+2H2O+2CO2→(x﹣1)S↓+H2S↑+2HCO3﹣;S2O32﹣+H2O+CO2→HSO3﹣+HCO3﹣+S↓
完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 .(答案用小数表示,保留2位有效数字)
(3)如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 .
(4)现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙.请推算这二种多硫化钙可能的物质的量之比 (写出推理过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各变化中属于原电池的反应的是( )
|
| A. | 在空气中金属铝表面迅速氧化形成保护层 |
|
| B. | 从海水中通过化学方法得到金属镁 |
|
| C. | 红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
|
| D. | 锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛.
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素.限选试剂与仪器:30% H2O2、0.1mol∙L﹣1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol∙L﹣1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
表中Vx= mL,实验目的是 .
(2)醋酸和盐酸是化学实验中常见的二种一元酸,某小组设计下列实验证明它们的电离程度.
实验一:室温下,测出0.1mol•L﹣1醋酸和盐酸pH值分别为3、1.提示:pH=﹣lgc(H+)
结论一:醋酸在水溶液中电离 (填“完全”、“不完全”).该温度下醋酸的电离度为 ;写出醋酸的电离方程式 .
实验二:现取等体积、浓度均为1mol•L﹣1醋酸和盐酸分别加入经砂纸打磨过的表面积相同的镁条.观察放出氢气速率的快慢.
结论二:其它条件相同时,同浓度同体积的一元酸与金属反应时,反应 (填“快”或“慢”)的为弱电解质.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中溶质的物质的量浓度为1mol•L﹣1的是( )
-A.-将58.5 g NaCl溶解于1 L水中配成的溶液
-B.-含K+为2 mol的K2SO4溶液
-C.-将0.5 mol•L﹣1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
-D.-将250 g 胆矾溶于水并配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验要注意安全,下列行为符合安全要求的是( )
|
| A. | 汽油着火时,立即用水灭火 |
|
| B. | 稀释浓硫酸时,将水倒入浓硫酸中 |
|
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
|
| D. | 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
|
| B. | 32g氧气所含原子数目为NA |
|
| C. | 17g氨气所含电子数目为10NA |
|
| D. | 1.8g水所含的质子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com