
【题目】某有机物的结构简式如右图 ,若等物质的量的该有机物分别与足量的Na、NaOH、Na2CO3、NaHCO3反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
,若等物质的量的该有机物分别与足量的Na、NaOH、Na2CO3、NaHCO3反应时,则消耗Na、NaOH、Na2CO3、NaHCO3的物质的量之比是( )
A. 3 :2 :1 :1 B. 3 :3 :2 :1
C. 2 :2 :1:1 D. 3:2:2:1
【答案】D
【解析】
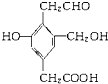 该有机物含酚-OH、醇-OH、-COOH、-CHO,结合酚、醇、羧酸的性质来解答.
该有机物含酚-OH、醇-OH、-COOH、-CHO,结合酚、醇、羧酸的性质来解答.
酚-OH、醇-OH、-COOH均与Na反应,则1mol该有机物与Na反应消耗3molNa,
酚-OH、-COOH与NaOH反应,则1mol该物质消耗2molNaOH,
酚-OH、-COOH与Na2CO3反应,则1mol该有机物消耗2molNa2CO3,
只有-COOH与NaHCO3反应,则1mol该物质消耗1molNaHCO3,
所以Na、NaOH、Na2CO3、NaHCO3分别与等物质的量的该物质恰好反应时,
Na、NaOH、Na2CO3、NaHCO3的物质的量之比为3:2:2:1=3:2:2:1,


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:。向体积可变的密闭容器中充入一定量的CH4(g)和O2(g)发生反应,CH4(g)的平衡转化率与温度(T)和压强(p)的关系如下图所示(已知T1>T2)。

下列说法正确的是
A. 该反应的△H>0
B. M、N两点的H2的物质的量浓度:c(M)>c(N)
C. 温度不变时,增大压强可由N点到P点
D. N、P两点的平衡常数:K(N)<K(P)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于该1,2—丙二醇的说法正确的是
A. 丙二醇可发生消去反应生成丙炔
B. 丙二醇可由丙烯在一定条件下与水加成制得
C. 丙烯与溴水加成后,再与NaOH醇溶液共热水解可得丙二醇
D. 丙二醇在铜存在下催化氧化可得到丙二醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:

请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。

I.将 NaOH溶液与 NH4Cl 溶液混合生成 NH3·H2O,从而验证 NaOH的碱性大于 NH3·H2O,继而可以验证 Na 的金属性大于 N,你认为此设计是否合理? 并说明理由:_____________________。
II.根据下图所示装置图回答以下问题。
(1)利用如图装置可以验证元素的非金属性的变化规律。图中 A 装置名称是____________,干燥管 D的作用是______________。
(2)实验室中现有药品Na2S、KMnO4、MnO2、浓盐酸,请从中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的离子方程式为_____________________。
(3)若要用此装置证明酸性: HNO3>H2CO3>H2SiO3 进而证明非金属性: N>C>Si,从以下所 给物质中选出甲同学设计的实验所用到物质:
①稀 HNO3溶液 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2
装置 A、C中所选试剂分别为______________(填序号);能说明酸性 H2CO3>H2SiO3的实验现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:

已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
(1)工业上常将“过滤Ⅰ”的滤液和滤渣洗涤液合并,其目的是____。
(2)“氧化”过程发生的离子方程式为___。
(3)“沉铁”过程中加入碳酸钠调节溶液的pH至2,碳酸钠过多会导致生成的沉淀由黄钠铁钒转变为_____(填化学式)。
(4)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的浓度为____。写出该条件下制备纳米镍粉同时生成N2的离子方程式:_____。

(5)不同NaOH浓度下,产物Ni的含量不同,可能的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。下列说法错误的是

A. 浸泡时加入乙醇有利于中草药有效成分的浸出
B. 高温条件下更有利于超临界CO2萃取
C. 升温、减压的目的是实现CO2与产品分离
D. CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有下列转化关系:

(1)A、E的结构简式为:A__________________________E__________________________
(2)反应①、⑤的反应类型是①__________________⑤__________________
(3)反应③的化学方程式为:__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com