
某小组同学为探究H2O2、H2SO3、Br2的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
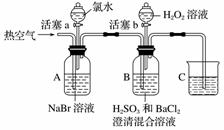
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,滴加氯水, 关闭活塞a | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是________________________________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________________________________________________________。
(3)装置C的作用是__________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式是________________________________________________________________________。
(5)由上述实验得出的结论是________________________________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是________________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可)________________________________________________________________________
答案 (1)2Br-+Cl2===Br2+2Cl-
(2)吹出单质Br2
(3)吸收尾气 NaOH溶液
(4)H2O2+2Br-+2H+===Br2+2H2O
(5)氧化性:H2O2>Br2>H2SO3
(6)①不干扰,无论热空气是否参加氧化H2SO3,只要观察到产生白色沉淀的同时混合液颜色无明显变化,即能证明Br2氧化了H2SO3
②H2SO3有剩余(或H2O2浓度小或Br-与H2O2反应慢等因素均可)
解析 操作Ⅰ的反应为Cl2+2Br-===Br2+2Cl-;操作Ⅱ,吹入热空气的目的是吹出Br2,然后在B中,Br2把H2SO3氧化成H2SO4,H2SO4和BaCl2反应生成BaSO4沉淀;操作Ⅲ,H2O2把Br-氧化成Br2而使溶液变成红棕色。综上所述,氧化性H2O2>Br2>H2SO3。(6)①若是O2氧化H2SO3,则溶液颜色有变化(变为红棕色)。


科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
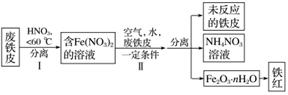
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为________________________________________________________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
________________________________________________________________________。
③上述生产流程中,能体现“绿色化学”思想的是___________________________________
________________________________________________________________________(任写一项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列八种不饱和烃:
A:CH2===CH—CH===CH2
B: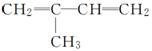
C:CH2===CH—CH===CH—CH3
D:
E:
F:CH≡CH
G:CH3—C≡CH
H:CH3—C≡C—CH3
(1)已知A+F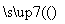
 ,若要合成
,若要合成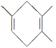 ,则下列所选原料正确的是________(填序号)。
,则下列所选原料正确的是________(填序号)。
①D和H ②E和H ③E和F ④B和H ⑤C和H
⑥D和G
(2)B和Br2的CCl4溶液发生反应时,可生成多种产物,写出这些产物的结构简式:______________________,____________________,________________________,__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
A.9.0 L B.13.5 L
C.15.7 L D.16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁燃料,其燃烧产物为________________。
(2)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________,
反应消耗1 mol NaBH4时转移的电子数目为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟用工业废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O]的操作流程如下:
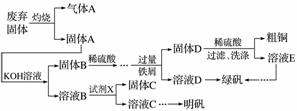
(1)试剂X是________(写化学式)。
(2)配平下列方程式:
MnO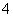 +____SO2+____H2O===____Mn2++____SO
+____SO2+____H2O===____Mn2++____SO +____H+
+____H+
(3)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0 g 样品配成100 mL溶液,移取25.00 mL于锥形瓶中,用1.000×10-1 mol·L-1的KMnO4标准溶液进行滴定(MnO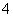 被还原为Mn2+)。
被还原为Mn2+)。
请回答下列问题:
①滴定时,KMnO4标准溶液应盛放在______________(填仪器名称)中。
②若到达滴定终点消耗KMnO4标准溶液的体积为25.00 mL,则该产品中铁元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO 、NO
、NO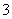 和少量Cr2O
和少量Cr2O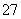 )回收与再利用工艺如下:
)回收与再利用工艺如下:

已知:①Cr(OH)3+OH-===CrO +2H2O;
+2H2O;
②2CrO +3H2O2+2OH-===2CrO
+3H2O2+2OH-===2CrO +4H2O;
+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250 mL 6 mol·L-1的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有________。
(2)滤液Ⅰ酸化前,进行加热的目的是________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是________________________。
(3)下表是相关物质的溶解度数据:
| 物质 | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①__________________、②__________。
(4)称取产品重铬酸钾试样2.000 g配成250 mL溶液,取出25.00 mL于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.120 0 mol·L-1 Na2S2O3标准溶液滴定(I2+2S2O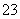 ===2I-+S4O
===2I-+S4O )。
)。
①若实验中共用去Na2S2O3标准溶液30.00 mL,所得产品中重铬酸钾的纯度为________(设整个过程中其他杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com